
Главная страница Случайная страница
КАТЕГОРИИ:
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Теоретическое обоснование
|
|
Реакцию окисления иодид-иона персульфатом калия (или натрия) относят к реакциям второго порядка, кинетическое уравнение которых можно записать так:
W=kCACB,
где СА-концентрация йодистого калия, СВ- концентрация персульфата калия (или натрия).
Если измерять скорость реакции в начальный период ее протекания, когда начальные концентрации реагирующих веществ еще не успели существенно измениться, то изменение концентрации одного из реагентов Δ СА мало, и, следовательно, производную от концентрации по времени можно заменить отношением конечных приращений: 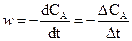 . Тогда кинетическое уравнение для описания процесса можно представить в виде выражения:
. Тогда кинетическое уравнение для описания процесса можно представить в виде выражения: 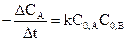 .
.
Если C0, A=C0, B ; CA=const (это означает, что в разных опытах начальные концентрации реагентов берутся одинаковыми и определяется промежуток времени Δ t, за которое концентрация вещества А изменяется на одну и ту же величину Δ CA), то k~1/Δ t и интегральная форма уравнения Аррениуса принимает вид:
.
Таким образом, энергию активации можно найти из графика, построенного в координатах ln(1/Δ t) – 1/Т, по формуле Δ E=-Rtgα.