
Главная страница Случайная страница
КАТЕГОРИИ:
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Отчет по работе
|
|
должен содержать:
-теоретическое обоснование экспериментальной части работы и методику эксперимента,
-экспериментально измеренные промежутки времени и их усредненные значения,
-график зависимости: 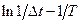 ,
,
-расчёт энергии активации,
- мотивированное обоснование ошибки измерения всех величин.
Лабораторная работа 6
ИЗУЧЕНИЕ КИНЕТИКИ РЕАКЦИЙ ВТОРОГО ПОРЯДКА НА ПРИМЕРЕ РЕАКЦИИ ИОДИРОВАНИЯ АЦЕТОНА В КИСЛОЙ СРЕДЕ
Теоретическое введение
Иодирование ацетона катализируется в водных растворах протонами
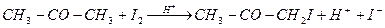 (32)
(32)
и протекает в две стадии:
1) энолизация ацетона (с образованием промежуточного вещества)
 ; (33)
; (33)
2) взаимодействие йода с энольной формой
 . (34)
. (34)
| ||
OH O
Первая реакция протекает значительно медленнее второй, поэтому скорость процесса определяется скоростью первой стадии, которая пропорциональна концентрации ацетона и ионов водорода, но не зависит от концентрации йода. Реакция проходит автокаталитически, так как ускоряется одним из продуктов реакции (Н+). В нейтральном разбавленном водном растворе она протекает очень медленно.
Скорость расходования ацетона выражается кинетическим уравнением второго порядка в соответствии с уравнением лимитирующей стадии:
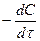 = k (C0 – Cх)(C0, H+ + Cx), (35)
= k (C0 – Cх)(C0, H+ + Cx), (35)
где C0 –концентрация ацетона начальная; C0, H+ - начальная концентрация ионов водорода; Cх – концентрация ацетона, подвергающаяся превращению за время t (убыль концентрации); t - время от начала реакции до данного измерения.
Интегрирование выражения (4) дает уравнение константы скорости процесса:
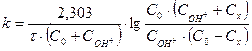 . (36)
. (36)
Для графической проверки это уравнение используют в линейной форме:
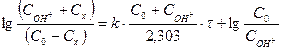 . (37)
. (37)