
Главная страница Случайная страница
КАТЕГОРИИ:
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Экспериментальная часть. В работе исследуется зависимость константы скорости реакции от начальной концентрации катализатора (по указанию преподавателя)
|
|
В работе исследуется зависимость константы скорости реакции от начальной концентрации катализатора (по указанию преподавателя), а также изучается первичный и вторичный солевой эффект.
В каждую из четырех 200 мл мерных колб вливают 25 мл 0, 1 N раствора йода в 4 %-ном растворе КI, прибавляют к нему 25 мл соляной кислоты концентрации от 0, 3 до 1, 5 N (по указанию преподавателя) и разбавляют дистиллированной водой до объема 150 мл.
Ацетон – около 1, 5 г – берут пипеткой (1, 6-2, 0 мл) и сливают в колбочку, содержащую 10 мл воды. Приготовленный раствор ацетона приливают в колбу с раствором йода и кислоты, после чего смесь доводят до метки дистиллированной водой. Момент вливания ацетона принимают за начало реакции. Аналогичную процедуру проделывают с остальными растворами йода с интервалом в 2-3 мин.
Первую пробу объемом 10 мл берут сразу же после доведения смеси до метки взбалтывания. Последующие пробы того же объема целесообразно брать через каждые 15-20 мин (всего 8-10 проб). Чем меньше концентрация кислоты, тем реже следует брать пробы.
Анализ пробы ведут следующим образом: пробу 10 мл вливают в 10 мл 0, 1 N раствора NaHCO3 и титруют по йоду 0, 01 N раствором Na2S2O3 с крахмалом в качестве индикатора. По ходу реакции время между последовательными титрованиями нужно постепенно увеличивать.
Концентрацию ацетона определяют по уравнению
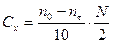 , (38)
, (38)
где nt - количество 0, 01 N Na2S2O3, израсходованного на титрование пробы, мл; n0 – количество Na2S2O3, которое должно быть израсходовано на титрование в момент начала реакции, мл; N – нормальность раствора Na2S2O3.
Значение n0 практически определить не удается, поскольку от момента вливания ацетона до момента взятия первой пробы проходит некоторое время. Поэтому для определения n0 строят график в координатах n = f(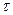 ) и экстраполяцией до
) и экстраполяцией до 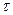 = 0 находят искомую величину.
= 0 находят искомую величину.
1. Расчет константы скорости проводят для каждой пробы и находят среднее значение.
2. Используя линейную форму уравнения (37), строят графики в координатах  . Из наклона каждой прямой находят значения констант скорости и сравнивают с рассчитанными kср.
. Из наклона каждой прямой находят значения констант скорости и сравнивают с рассчитанными kср.
3. Строят график зависимости константы скорости от концентрации кислоты.
4. Данные эксперимента и расчеты помещают в табл. 5.
Таблица 5
| Объем титруемой пробы – 10 мл, … г-экв/л, объем прибавленной кислоты – 25 мл, … г-экв/л, Нормальность кислоты - … N | |||||||
| № | 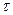
| n 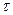
| Cx | 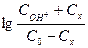
| k | kср | lg kcp |