
Главная страница Случайная страница
КАТЕГОРИИ:
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Экспериментальная часть. Исследование кинетики газовой коррозии проводится по методике периодического взвешивания на лабораторной установке
|
|
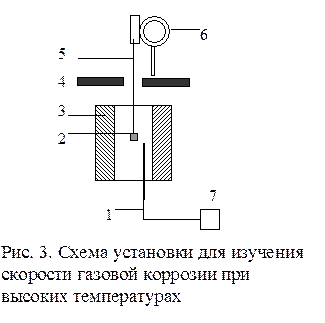 Исследование кинетики газовой коррозии проводится по методике периодического взвешивания на лабораторной установке, схема которой приведена на рис. 4.
Исследование кинетики газовой коррозии проводится по методике периодического взвешивания на лабораторной установке, схема которой приведена на рис. 4.
Испытуемый образец 2 подвешивают на нихромовом или кварцевом подвесе 5, состоящем из нескольких звеньев, в вертикальной трубчатой печи сопротивления 3, к коромыслу аналитических весов 6. Температуру в печи замеряют хромель-алюмелевой термопарой 1 и записывают на потенциометре КСП – 4 – 7. Конец термопары должен находиться вблизи испытуемого образца. Чтобы избежать нагрева весов, между печью и весами устанавливается экран 4.
Работа по исследованию скорости окисления металла проводится следующим образом: включают обогрев печи и потенциометр КСП – 4. По достижению заданной температуры (регулируют при помощи ЛАТРа) подвешивают в печи испытуемый образец 2 и через 1 – 2 мин его взвешивают. За это время образец принимает температуру печи, но еще не успевает заметно окислиться. Далее в течение 1 – 2 ч через заданные преподавателем промежутки времени продолжают взвешивание образца. По окончании опыта при данной температуре образец вынимают, устанавливают в печи следующую заданную температуру, подвешивают в печи новый образец такого же металла и повторяют опыт в том же порядке.
Результаты опытов по исследованию кинетики газовой коррозии сводят в таблицу по образцу. По табличным данным для каждой температуры строят графики в координатах G1 – τ, Δ G12 – τ и Δ G1 – ln τ, устанавливая таким образом, по какому закону идет окисление в определенной температурной области.
| Темпе-ратура, К | Металл и номер образца | Поверхность образца, м2 | Вермя и но-мер вз-вешивания | Время от начала опыта, τ | Масса образца, G1, кг | Привес Δ G1, кг | Привес на единицу поверхности Δ G1, кг |
Установив характер кривой и какому уравнению она подчиняется, рассчитывают константу скорости окисления при любой температуре, а затем определяют энергию активации и получают расчетное уравнение процесса окисления в зависимости от температуры. Для определения константы скорости окисления расчет проводится по формулам:
- при прямолинейном характере кривых окисления 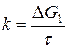 ;
;
- при параболическом характере кривых 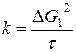 ;
;
- при логарифмическом законе окисления  .
.
Контрольные вопросы
1. Почему нет единого уравнения для газовой коррозии металлов?
2. Каковы признаки диффузионного торможения гетерогенного процесса?
3. Напишите уравнения Фика для 1 и 2 закона диффузии.
4. Расскажите о механизмах окисления различных металлов.
Лабораторная работа 8