
Главная страница Случайная страница
КАТЕГОРИИ:
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Последовательность выполнения работы. Отвесить на технических весах две навески по 5 г кристаллической глюкозы
|
|
Отвесить на технических весах две навески по 5 г кристаллической глюкозы. Одну из них поместить в мерную колбу вместимостью 50 мл. Отметив время, быстро довести объем колбы водой до метки, перемешать и отметить момент полного растворения глюкозы. Время – среднее между началом и концом растворения глюкозы – принять за момент начала реакции.
Примечание. Если скорость реакции изучается при температуре, отличающейся от комнатной, то вода, в которой растворяется глюкоза, должна быть предварительно нагрета до температуры опыта.
Раствор, если он мутный, отфильтровать и налить в поляриметрическую трубку, предварительно дважды сполоснув ее этим же раствором. Затем измерить углы вращения плоскости поляризации. После первого измерения перенести вторую навеску в 50–миллилитровую мерную колбу, растворить ее в соляной кислоте заданной концентрации идовести водой объем раствора в колбе до метки. За начало реакции принимается время, среднее между началом и концом растворения глюкозы. Измерения углов вращения плоскости поляризации для смеси с катализатором чередуют с измерениями для смеси, в которой идет самопроизвольная мутаротация.
Для определения конечного угла вращения плоскости поляризации a¥ часть раствора, оставшегося после заполнения трубки, поместить в термостат при 40°С, где и выдержать в течение всего опыта. По окончании измерений определить угол вращения плоскости поляризации оставшегося раствора, охладив его до температуры опыта. Начальный угол вращения плоскости поляризации раствора a0 рассчитать экстраполяцией зависимости lg(at – a¥ ) на нулевое время реакции. Обработку полученных данных произвести в той же последовательности, как и в работе 2. Затем вычислить константы скорости реакции без катализатора и в присутствии катализатора по уравнению
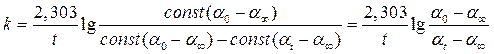
Используя опытные данные, вычислить по уравнению k = k0 + ac, где k и k0 – константа скорости реакции в присутствии и отсутствии катализатора, соответственно, a – каталитический коэффициент, c – концентрация катализатора каталитический коэффициент, предполагая, что действие катализатора пропорционально его концентрации.
Вычислить и аналитически, и графическим путем, как это средние константы скорости k0 и k. Результаты наблюдений записать в таблицу 6.
Таблица 6
| Мутаротация в отсутствие катализатора | Мутаротация в присутствии катализатора | ||||||||||
| Время измерения | Промежуток времени от начала реакции, мин | at | at – a¥ | k0 (с указанием размерности) | k0, ср | Время измерения | Промежуток времени от начала реакции, мин | at | at – a¥ | k0 (с указанием размерности) | k0, ср |
КОНТРОЛЬНЫЕ ВОПРОСЫ К экспериментальным
работам
1. Скорость гомогенной химической реакции и закон действия масс.
2. Константа скорости химической реакции, её физический смысл. Связь между константой равновесия и константами скоростей прямой и обратной реакции.
3. Влияние температуры на скорость химической реакции. Основное уравнение химической кинетики Аррениуса и его анализ. Энергия активации и её сущность.
4. Показать графически или на основе уравнения Аррениуса связь, существующую между тепловым эффектом всей реакции и энергиями активации прямой и обратной реакции.
5. Экспериментальные методы определения энергии активации.
6. Молекулярность и порядок реакции. Методы экспериментального определения порядка реакции.
7. Характеристика реакций 1-го и 2-го порядков.
8. Особенности обратимых, параллельных и последовательных реакций.
9. Почему бимолекулярные реакции (9.7) и (9.9) протекают по механизму реакций первого порядка?
10. Почему в работах 21 и 23 титрование рабочей смеси производят в предварительно охлаждённой воде?
11. Показать, почему в работе 21 количество неизрасходованного эфира пропорционально разности объемов барита, израсходованных при последнем титровании и при титровании в момент времени t.
12. Какой свет называют поляризованным? Что называют плоскостью поляризации? Назначение поляризатора и анализатора в поляриметре.
13. Какому положению главных осей в призмах Николя соответствует равномерное затемнение поля зрения?
14. Дать характеристику оптической активности участников реакции инверсии сахара. Показать, почему остаточная концентрация сахара в смеси пропорциональна разности (a i -a¥ ).
15. Исходя из уравнения (9.12), получить уравнение (9.12I). Объяснить осуществленную в уравнении (9.12II) замену концентраций соответствующими объемами соляной кислоты, израсходованными на титрование.
16. Сказывается ли на величине энергии активации, определяемой в работе 23, замена истинной константы скорости (К) условной (К¢)? Как можно было бы пересчитать К¢ на действительное значение константы скорости ² К²?
Литература
1.Физическая химия. Теоретическое и практическое руководство. Изд. 2-ое, пер. и доп. Под ред. академика Никольского Б.П.- Л.: Химия. 1987.880с.
2.Линчевский Б.В. Физическая химия. – М.: МГВМИ. 2001. 256 с.
3.Семиохин И.А. Физическая химия. – М.: МГУ. 2001. 270 с.
4.Карапетьянц М.Х. Химическая термодинамика. –М.: Химия. 1973. 584 с.
5.Физическая химия. Кн.1 Строение вещества. Термодинамика. Изд. 2-ое, пер. и доп. Под ред. проф. Краснова К.С. – М.: Высшая школа. 1995. 512 с.
6.Мелвин-Хьюз Э.А. Физическая химия. В 2-х книгах. Под ред. чл.-корр. АН СССР Герасимова Я.И. – М.: Изд-во иностранной литературы. 1962.1148 с.
7.Стромберг А.Г., Семченко Д.П. Физическая химия. – М.: Высшая школа. 1999. 528с.
8.Герасимов Я.И., Древинг В.П., Еремин Е.Н., Киселев А.В., Лебедев В.П., Панченков Г.М., Шлыгин А.И. Курс физической химии. Под общей ред. чл.-корр. АН СССР Герасимова Я.И. Том 2. –М.-Л.: Химия. 1973. 624с.
9.Воробьев Н.К., Гольцшмидт В.А., Карапетьянц М.Х., Киселева В.Л., Краснов К.С. Практикум по физической химии. Изд.3-е, пер. и доп. –М.: Химия.1964. 384с.
10.Практикум по физической химии. Под редакцией Буданова В.В. и Воробьева Н.К. Изд. 5-е. - М.: Химия. 1986. 352 с.
Таблица 5
| 0С = …, СН2О2 = … N, VH2O2 = … мл, VK2Cr2O7 = … мл, концентрация исходного раствора катализатора К2Cr2O7 | ||||||||||
  Концентра-ция раствора катализатора в реакторе Cr2O72- Концентра-ция раствора катализатора в реакторе Cr2O72-
| t, мин | Объем кислоро-да V, мл | Кол-во выделен-ного кислоро-да nO2, моль | Кол-во оставшейся перекиси nH2O2 = 2[nO2¥ - nO2t], моль | Концентрация оставшейся перекиси CH2O2= (nH2O2´ 100) (V1+V2) | Скорость разложе-ния Н2О2, u = DСН2О2/Dt | ¾ ¾ ¾ DСН2О2 Dt | ¾ ¾ С2Н2О2 | k, с-1 | К, (моль/л)-2 |
Таблица 6
| СН2О2 = …N, VН2О2 = … мл, количество угля = … г | |||||||||
| t, мин | Объем кислоро-да V, мл | Кол-во выделивше-гося кислорода nO2, моль | Кол-во оставшейся перекиси nH2O2, моль | Концентрация оставшейся перекиси СН2О2 | Скорость разложения Н2О2 u | LgCH2O2 | Lgu | k, c-1 | Порядок реакции n |