
Главная страница Случайная страница
КАТЕГОРИИ:
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Гомогенный катализ
|
|
Простейшая схема гомогенного катализа включает обратимое образование промежуточного комплекса катализатора (K) с одним из реагирующих веществ A, B и превращение этого комплекса в продукты реакции C, D с высвобождением катализатора:
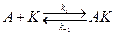
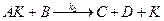
Применение квазистационарного приближения к этой схеме (при условии k 2 > > k 1) позволяет выразить скорость образования продуктов через концентрации реагентов и катализатора:
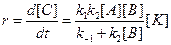 . (16)
. (16)
Это уравнение лежит в основе кинетики гомогенно-каталитических реакций. Из него видно, что скорость реакции прямо пропорциональна концентрации катализатора, что хорошо согласуется с опытными данными для многих реакций. Многие гомогенные реакции катализируются кислотами или основаниями. Реакции, катализируемые ионами H+ (H3O+) или OH–, относят к специфическому кислотному или основному катализу. Простейшие механизмы этих реакций включают обратимое взаимодействие субстрата (S) с каталитической частицей и превращение образующегося комплекса в продукт (P):
специфический кислотный катализ: 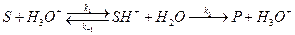 ;
;
специфический основной катализ: 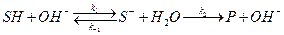 .
.
Специфический кислотный катализ характерен для реакций дегидратации спиртов и кето-енольной таутомеризации, а специфический основной катализ – для альдольной конденсации. Гидролиз сложных эфиров ускоряется как в кислой, так и в щелочной среде. Скорость каталитической реакции пропорциональна концентрации протонированной формы субстрата:
r=k2[SH+]. (17)
В квазиравновесном приближении эту концентрацию можно выразить через константу основности субстрата:
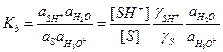 , (18)
, (18)
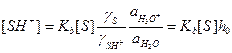 , (19)
, (19)
где γ – коэффициент активности, a – активность, 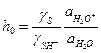 – кислотность среды, определяемая с помощью индикатора с известным значением Kb. Чем больше значение h 0, тем сильнее протонирован субстрат. В разбавленном водном растворе все коэффициенты активности и активность воды равны 1, поэтому кислотность совпадает с концентрацией ионов гидроксония: h 0 = [H3O+].
– кислотность среды, определяемая с помощью индикатора с известным значением Kb. Чем больше значение h 0, тем сильнее протонирован субстрат. В разбавленном водном растворе все коэффициенты активности и активность воды равны 1, поэтому кислотность совпадает с концентрацией ионов гидроксония: h 0 = [H3O+].
Логарифм кислотности, взятый с обратным знаком, называют функцией кислотности Гаммета: H 0 = –lg h 0. Эту величину используют для характеристики кислотности среды в концентрированных водных растворах, где активности значительно отличаются от концентраций. В разбавленных водных растворах функция кислотности совпадает с водородным показателем: H 0 = pH.
Текущая концентрация субстрата связана с его начальной концентрацией уравнением материального баланса: [S]0 = [S] + [SH+]. Учитывая это соотношение, а также уравнения (17) и (19), выражаем скорость каталитической реакции через начальную концентрацию субстрата: r = k[S]0,
где эффективная константа скорости k зависит от кислотности среды h 0:
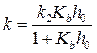 . (20)
. (20)
Измеряя константу скорости в растворах с разной кислотностью, можно определить значения k 2 и Kb.
Общий кислотный или основной катализ осуществляется кислотами (HA) или основаниями (B) Бренстеда:
общий кислотный катализ –  ;
;
общий основной катализ – 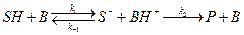 .
.
В этом случае каталитический эффект зависит от природы кислоты или основания, служащих катализаторами. Эта зависимость определяется, главным образом, силой кислоты или основания. Для реакций общего кислотного или основного катализа с одним и тем же субстратом известны корреляционные соотношения Бренстеда между константами скорости каталитических реакций и константами кислотности (Ka) или основности (Kb) катализатора:
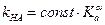 ,
,
 ,
,
где α и β – эмпирические параметры, не превышающие 1 и постоянные для данной реакции.
При кинетическом анализе общего кислотного катализа наряду с каталитическим действием кислоты HA необходимо учитывать влияние ионов H3O+ и самой воды, поэтому кинетические уравнения имеют вид:
 (21)
(21)
При постоянных pH и концентрации катализатора это уравнение описывает реакцию первого порядка. Аналогичное уравнение для общего основного катализа выглядит следующим образом:
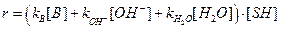 (22)
(22)
Из соотношений для специфического кислотного катализа следует, что константа скорости зависит от коэффициентов активности, которые, в свою очередь, определяются ионной силой раствора. Поэтому изменение ионной силы раствора может повлиять на скорость каталитической реакции. Это влияние называют первичным солевым эффектом. Из соотношений (21, 22) для общего кислотно-основного катализа видно, что скорость реакции зависит от концентрации кислоты или основания. Добавление к раствору одноименных ионов A– или BH+ приведет к смещению кислотно-основного равновесия и увеличению этих концентраций, поскольку
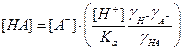 , (23)
, (23)
что повлияет на константу скорости. Это явление называют вторичным солевым эффектом.
Лабораторная работа 1