
Главная страница Случайная страница
КАТЕГОРИИ:
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Скорость химических реакций
|
|
ОСНОВЫ ХИМИЧЕСКОЙ КИНЕТИКИ.
ХИМИЧЕСКОЕ РАВНОВЕСИЕ
Химическая кинетика - раздел химии, изучающий скорости химических процессов, а также зависимость их от различных факторов.
Теоретическое значение кинетики состоит в том, что она позволяет проникнуть в сущность механизма химического взаимодействия. Прикладное значение кинетики определяется тем, что для практического использования какой - либо реакции необходимо управлять ею, т.е. знать скорость ее протекания в данных условиях и способы изменения этой скорости.
С точки зрения течения во времени любой химический процесс можно представить в виде следующей записи:
Реагенты (исходные вещества) ® переходное состояние ® продукты реакции
Реагенты (исходные вещества) - вещества, вступающие в процесс химического взаимодействия.
Продукты реакции - вещества, образующиеся в процессе химического превращения и не претерпевающие в ходе этого процесса дальнейших химических изменений.
Необратимые реакции - реакции, протекающие при данных условиях только в одном направлении (обозначают знаком ® или =).
Обратимые реакции - реакции, протекающие при данных условиях одновременно в двух противоположных направлениях (обозначают знаком «или =).
СКОРОСТЬ ХИМИЧЕСКИХ РЕАКЦИЙ
Химические реакции могут совершаться медленно, в течение целых геологических периодов, как, например, выветривание горных пород, которое представляет собой превращения алюмосиликатов:
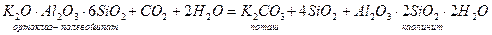
или очень быстро, в микросекунды или их доли, как, например, горение черного пороха:
3C + S + 2KNO3 = N2 + 3CO2 + K2S
В связи с этим любое химическое взаимодействие можно, как всякий другой процесс, характеризовать скоростью, которая служит количественной мерой интенсивности его протекания.
Скоростью химической реакции называется число элементарных актов реакции, происходящих в единицу времени в единице реакционного пространства.
Для гомогенных процессов реакционным пространством является объем реакционного сосуда, а для гетерогенных - поверхность, на которой протекает реакция. Например, гетерогенными являются системы типа:
г + т; г + ж; ж + т; г + ж + т; 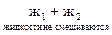
Скорость химической реакции определяют изменением количества любого участника реакции в единицу времени в единице реакционного пространства. В связи с тем, что в реакции принимают участие в качестве реагентов и продуктов реакции несколько веществ, можно говорить не о скорости химического процесса вообще, а о скорости реакции по некоторому веществу.
Изменение (D) количества этого вещества следует выражать числом моль (n) этого вещества, прореагировавшего за промежуток времени от t1 до t2 (Dt) в единице объема (V):
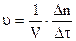
Так как отношение 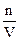 = с, т.е. равно концентрации вещества, то для гомофазных реакций, идущих при постоянном объеме (V = const), выражение переходит в
= с, т.е. равно концентрации вещества, то для гомофазных реакций, идущих при постоянном объеме (V = const), выражение переходит в
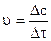 , где u - средняя скорость реакции.
, где u - средняя скорость реакции.
Скорость реакции всегда определяется как величина положительная. В связи с тем, что в ходе реакции концентрации реагентов уменьшаются, а концентрации продуктов возрастают, для величины скорости реакции можно записать два равноценных выражения:
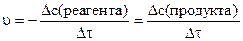 (5.3)
(5.3)
|

Чтобы получить истинную (мгновенную) скорость процесса в данный момент времени t, надо от конечных приращений (D) перейти к бесконечно малым (d):
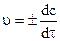
где u - истинная скорость реакции.
Таким образом, для гомофазного химического процесса, идущего при постоянном объеме, скорость процесса по некоторому веществу измеряется изменением концентрации этого вещества в единицу времени.
Обычно размерность скорости u |моль/л× с|. Для гетерогенных систем скорость реакции относится к единице площади поверхности, на которой протекает реакция, поэтому u |моль/л× с× м2|.
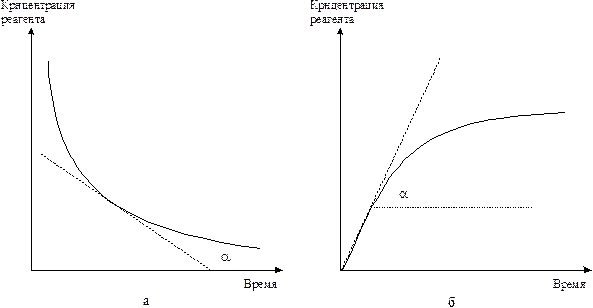 Рис. 5. 2. Изменение концентрации реагента (а) и продукта реакции (б) от времени.
Рис. 5. 2. Изменение концентрации реагента (а) и продукта реакции (б) от времени.