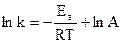Главная страница Случайная страница
КАТЕГОРИИ:
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Влияние температуры на скорость химической реакции
|
|
Изменение температуры оказывает резкое влияние на константу скорости, а следовательно, и на скорость химической реакции. В подавляющем большинстве случаев скорость химической реакции с нагреванием возрастает.
В 1879 г. голландский исследователь Г. Вант-Гофф обнаружил, что при повышении температуры на каждые 10 градусов скорость гомогенной химической реакции возрастает, в среднем, в 2-4 раза (правило Вант-Гоффа):
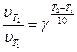
где  - скорость реакции при температуре T1 (начальная температура системы);
- скорость реакции при температуре T1 (начальная температура системы);
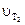 - скорость реакции при температуре T2 (конечная температура системы);
- скорость реакции при температуре T2 (конечная температура системы);
g - температурный коэффициент реакции. Это число, показывающее, во сколько раз возрастает скорость данной реакции при повышении температуры на 10 градусов.
Влияние температуры на скорость реакции тем значительнее, чем больше значение g. Так, если g равен трем, то при увеличении температуры на 100 ° скорость реакции возрастет в 310 раза, т.е. приблизительно в 59 тыс. раз. Следует иметь в виду, что правило Вант-Гоффа позволяет лишь примерно оценить влияние температуры на скорость реакции.

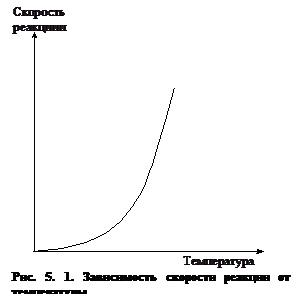
Графическая зависимость скорости реакции от температуры показана на рис.
 В чем причина такого эффективного влияния? С увеличением температуры возрастает кинетическая энергия частиц, особенно в газовой фазе. Это приводит к увеличению числа соударений частиц, которое можно рассчитать на основе кинетической теории газов.
В чем причина такого эффективного влияния? С увеличением температуры возрастает кинетическая энергия частиц, особенно в газовой фазе. Это приводит к увеличению числа соударений частиц, которое можно рассчитать на основе кинетической теории газов.
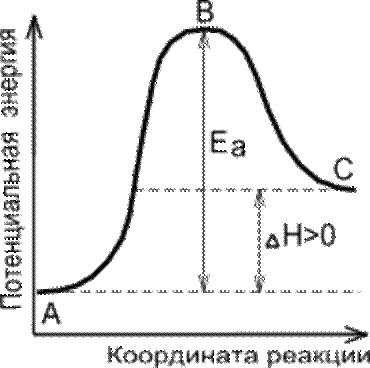
Несоответствие теоретически ожидаемой и действительной скорости привело к выводу (шведский химик С. Аррениус, 1889 г.),

что не каждое соударение частиц эффективно и химическое взаимодействие имеет место, только если сталкивающиеся частицы обладают определенным избытком энергии по сравнению со средней энергией данных частиц.
Минимальную энергию, необходимую для того, чтобы произошло химическое взаимодействие, называют энергией активации (Еа).
Частицы, обладающие таким и большим запасом энергии, называют активными.
Например, для зажигания спички ее предварительно нагревают посредством трения, а для зажигания смеси бензина с воздухом в автомобильном двигателе используется энергия искры.
Количественная закономерность, описывающая влияние температуры на константу скорости одностадийной реакции, выражается уравнением С. Аррениуса (1889 г.):
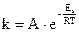 ,
,
где k - константа скорости реакции;
A - предэкспоненциальный множитель - постоянная величина, определяемая природой реагентов;
Eа - энергия активации;
R - универсальная газовая постоянная;
e = 2, 71828 - основание натуральных логарифмов;
T – температура;
Чем больше величина Еa, тем меньше скорость реакции. Если же энергия активации остается постоянной, а температура повышается, то указанная доля молекул, определяемая выражением 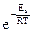 , становится больше. Экспериментально установлено, что реакции, для которых значение энергии активации превышает 150 кДж/моль, при комнатных температурах не протекают, даже если DG < 0 (так называемое «кинетическое препятствие»). В то же время ионные реакции обмена в растворах электролитов протекают с высокими скоростями, т.к. Еa подобных реакций близка к нулю. В химической кинетике часто используют уравнение Аррениуса в логарифмической форме:
, становится больше. Экспериментально установлено, что реакции, для которых значение энергии активации превышает 150 кДж/моль, при комнатных температурах не протекают, даже если DG < 0 (так называемое «кинетическое препятствие»). В то же время ионные реакции обмена в растворах электролитов протекают с высокими скоростями, т.к. Еa подобных реакций близка к нулю. В химической кинетике часто используют уравнение Аррениуса в логарифмической форме: