
Главная страница Случайная страница
КАТЕГОРИИ:
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Константа химического равновесия
|
|
Рассмотрим особенности протекания обратимых процессов на примере системы, которая в общем виде имеет вид:
aA + bB «pP + qQ
при условии, что прямая (®) и обратная () реакции протекают в одну стадию.
Согласно закону действия масс скорости прямой (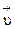 ) и обратной (
) и обратной (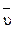 ) реакций описываются следующими кинетическими уравнениями:
) реакций описываются следующими кинетическими уравнениями:
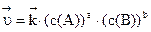
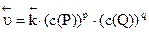 ,
,
где 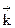 и
и 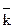 - константы скорости, соответственно, прямой и обратной реакций.
- константы скорости, соответственно, прямой и обратной реакций.
Состояние системы, при котором 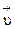 =
= 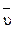 , называется динамическим равновесием.
, называется динамическим равновесием.
Это равновесие является динамическим (подвижным) поскольку в системе протекает двусторонняя реакция - в прямом (A и B - реагенты, P и Q - продукты) и в обратном (A и B - продукты, P и Q - реагенты) направлениях.
В равновесной системе концентрации всех участников процесса при данных условиях не изменяются, так как в ней постоянно и с одинаковой скоростью протекают прямая и обратная реакции.
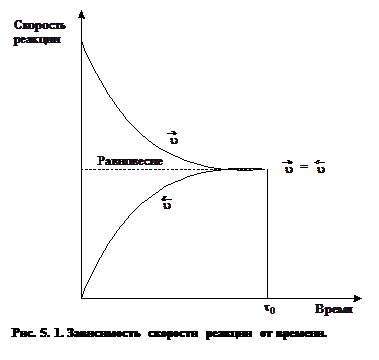 Подход к состоянию равновесия при Т = const может быть осуществлен как в прямом, так и в обратном направлениях.
Подход к состоянию равновесия при Т = const может быть осуществлен как в прямом, так и в обратном направлениях.
Выведем количественную характеристику химического равновесия.
В состоянии равновесия
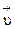 =
= 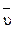 , т.е.
, т.е.
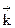 × [A]a× [B]b =
× [A]a× [B]b = 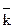 × [P]p× [Q]q,
× [P]p× [Q]q,