
Главная страница Случайная страница
КАТЕГОРИИ:
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Где символами [ ] обозначены молярные концентрации реагентов в момент равновесия, называемые равновесными концентрациями.
|
|
Константа скорости данной реакции при фиксированной температуре постоянна, поэтому будет постоянным и отношение 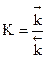 , называемое константой химического равновесия.
, называемое константой химического равновесия.
Таким образом, получим:
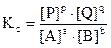
где Kc - константа химического равновесия, выраженная через равновесные концентрации участников реакции.
Например, для обратимых систем,
2NO2(г) «N2O4(г)
CO(г) + H2O(пар) «CO2(г) + H2(г)
выражения констант равновесия имеет вид:
 и
и 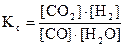
Если в процессе химического превращения участвуют две или несколько фаз, то в выражении для константы равновесия следует учитывать только те из них, в которых происходят изменения концентраций реагентов. Например, выражения констант равновесия для систем:
CaCO3(т) «CaO(т) + CO2(г)
3Fe(т) + 4H2O(пар) «Fe3O4(т) + 4H2(г)
Кс = [CO2] и 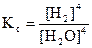 , т.е. концентрации твердого вещества не входят в выражение константы равновесия.
, т.е. концентрации твердого вещества не входят в выражение константы равновесия.