
Главная страница Случайная страница
КАТЕГОРИИ:
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Нақты газдар.
|
|
Идеал газ заң дарын қ арастырғ анда біз идеал газ молекулаларының сызық тық ө лшемдері ескерусіз жә не молекулалары бір-бірімен ө зара ә серлеспейді деп қ арастырдық.
1. Идеал газ заң дары – жуық талғ ан заң дар. Олардың ауытқ уларында сандық та, сапалық сипаттары бар. Менделеев-Клапейрон тең деуі 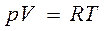 нақ ты газдар ү шін тек жуық талып қ ана орындалады. Сапалық ауытқ уларғ а келсек, оның сипаты терең ірек жатыр. Нақ ты газдарды сұ йық жә не қ атты кү йлерге ө ткізуге болады. Ал егер газдар Менделеев-Клапейрон тең деуіне қ атаң бағ ынатын болса, онда бұ л мү мкін болмағ ан болар еді.
нақ ты газдар ү шін тек жуық талып қ ана орындалады. Сапалық ауытқ уларғ а келсек, оның сипаты терең ірек жатыр. Нақ ты газдарды сұ йық жә не қ атты кү йлерге ө ткізуге болады. Ал егер газдар Менделеев-Клапейрон тең деуіне қ атаң бағ ынатын болса, онда бұ л мү мкін болмағ ан болар еді.
2. Алыс қ ашық тық тарда молекулалық кү штер тартылыс кү штері болып табылады. Бұ л тартылыс кү штерін нақ ты газдардың молекулалық теориясының негізін қ алағ ан голланд ғ алымының есімімен Ван-дер-Ваальс (1837-1923) кү штері деп атайды. Тұ тастай алғ анда электр бейтерап болатын, элементар зарядтардан тү зілген бұ л кү рделі бө лшектердің арасында тартылыс кү штері қ алай пайда болуы мү мкін? Мұ ны тү сіну ү шін екі жағ дайғ а назар аудару керек. Біріншіден қ арама-қ арсы зарядтар бө лшек ішінде бір нү ктеде жинақ талмағ ан. Осының арқ асында олардың сыртқ ы ө рісі ө шпейді – кез келген атом немесе молекуланың тө ң ірегінде қ ашық тық артқ ан кезде жеткілікті тез ө шетін электр ө рісі болады. Екіншіден сыртқ ы ө рістің ә серінен молекула ішіндегі зарядтардың орны немесе қ озғ алысы оң зарядтар ө ріс бағ ытында, ал теріс зарядтар – қ арсы бағ ытта ығ ысатындай болып, сә л-дә л ө згереді. Бұ л қ ұ былыс электр поляризация деп аталады. Енді бір-бірінен ө те азғ антай қ ашық тық та орналасқ ан 1 жә не 2 кү рделі бейтерап бө лшектерді қ арастырайық: ә лі де болса, бірінші бө лшектің екінші бө лшектің тұ рғ ан жерінде тудыратын  ө рісінің мә ні назар аударалық тай болсын. Осы ә серінен
ө рісінің мә ні назар аударалық тай болсын. Осы ә серінен  ө рістің ә серінен 2 бө лшек полярланады, сө йтіп оның бірінші бө лшек тұ рғ ан жеріндегі
ө рістің ә серінен 2 бө лшек полярланады, сө йтіп оның бірінші бө лшек тұ рғ ан жеріндегі  электр ө рісі кү шееді.
электр ө рісі кү шееді. 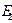 ө рістің ә серінен бірінші бө лшек те полярланады, бұ л да
ө рістің ә серінен бірінші бө лшек те полярланады, бұ л да 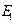 ө рістің кү шеюіне ә кеп тірейді жә не т.с.с. Осылардың нә тижесінде бө лшектер бір-біріне қ арама-қ арсы зарядталғ ан бү йірлерімен бұ рылып тұ ратын болады. Олар бір-біріне қ арама-қ арсы полюстерімен қ арап тұ рғ ан магниттер тә різді тартылатын болады. Қ арастырылғ ан кү штер дисперсиялық кү штер дисперсиялық кү штер деп аталады.
ө рістің кү шеюіне ә кеп тірейді жә не т.с.с. Осылардың нә тижесінде бө лшектер бір-біріне қ арама-қ арсы зарядталғ ан бү йірлерімен бұ рылып тұ ратын болады. Олар бір-біріне қ арама-қ арсы полюстерімен қ арап тұ рғ ан магниттер тә різді тартылатын болады. Қ арастырылғ ан кү штер дисперсиялық кү штер дисперсиялық кү штер деп аталады.
3. Молекулалардың ө зара ә рекеттесуін 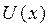 потенциалдық энергиясымен сипаттағ ан ың ғ айлы, бұ л функция ө зара жақ ындағ ан молекулалардың центрлерінің х арақ ашық тығ ына тә уелді. Айтылып кеткендерге сай
потенциалдық энергиясымен сипаттағ ан ың ғ айлы, бұ л функция ө зара жақ ындағ ан молекулалардың центрлерінің х арақ ашық тығ ына тә уелді. Айтылып кеткендерге сай 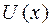 функцияның тү рін 2-суреттегідей тү рде беруге болады. Оның минимумы бар, онда тартылыс кү штері тебілу кү штерімен тең геріседі.
функцияның тү рін 2-суреттегідей тү рде беруге болады. Оның минимумы бар, онда тартылыс кү штері тебілу кү штерімен тең геріседі.
Газдар теориясының кө птеген мә селелерінде 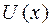 функциясы ү шін
функциясы ү шін
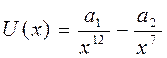
жуық талуын пайдаланады, мұ ндағ ы 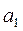 жә не
жә не 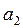 - тұ рақ тылар. Бұ л функция Леннард – Джонс потенциалы деп аталады. Бірінші мү ше тебілу кү штеріне, ал екінші мү ше – Ван-дер-Ваальс тартылыс кү штеріне сә йкес келеді. Тартылыс кү штері қ ашық тығ ының жетінші дә режесіне кері пропорционал болады. (себебі
- тұ рақ тылар. Бұ л функция Леннард – Джонс потенциалы деп аталады. Бірінші мү ше тебілу кү штеріне, ал екінші мү ше – Ван-дер-Ваальс тартылыс кү штеріне сә йкес келеді. Тартылыс кү штері қ ашық тығ ының жетінші дә режесіне кері пропорционал болады. (себебі  ). Бірінші мү ше жай ғ ана жуық тау деп алуғ а болады.
). Бірінші мү ше жай ғ ана жуық тау деп алуғ а болады.
Ван-дер –Ваальстың кү й тең деуі теориясындағ ы жуық талу бойынша 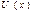 функциясының графигіндегі сол жақ тағ ы тік дерлік кө терілетін учаскесі вертикаль тү зумен алмастырылады. Егер d осы тү зуден координаттар басына дейінгі қ ашық тық болса, онда ө зара ә рекеттесуші бө лшектердің центрлері қ ашық тық тан кіші қ ашық тық қ а тең бола алмайды, олар бұ дан жақ ынырақ жерге келе алмайды. Қ арастырылып отырғ ан жуық талу арасында тартылыс кү штері ә сер ететін серпімді қ атты шарлар моделіне сә йкес келеді. Осы модельді біз пайдаланымыз. Тебілу кү штерін ескеру арқ ылы бір шарлардың мө лшерлерін шектеулі деп санаймыз. Бұ л кү штер тек соқ тығ ысулар кезінде ғ ана пайда болады. D қ ашық тық молекуланың диаметрі рө лін атқ арады.
функциясының графигіндегі сол жақ тағ ы тік дерлік кө терілетін учаскесі вертикаль тү зумен алмастырылады. Егер d осы тү зуден координаттар басына дейінгі қ ашық тық болса, онда ө зара ә рекеттесуші бө лшектердің центрлері қ ашық тық тан кіші қ ашық тық қ а тең бола алмайды, олар бұ дан жақ ынырақ жерге келе алмайды. Қ арастырылып отырғ ан жуық талу арасында тартылыс кү штері ә сер ететін серпімді қ атты шарлар моделіне сә йкес келеді. Осы модельді біз пайдаланымыз. Тебілу кү штерін ескеру арқ ылы бір шарлардың мө лшерлерін шектеулі деп санаймыз. Бұ л кү штер тек соқ тығ ысулар кезінде ғ ана пайда болады. D қ ашық тық молекуланың диаметрі рө лін атқ арады.
2-cурет
Молекулалардың алып тұ рғ ан кө леміне басқ а молекулалардың еніп кетуіне қ арама-қ арсы ә сер ететін тебілу кү ші пайда болады. Сонда нақ ты газдың еркін қ озғ ала алатын кө лемі 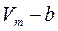 тең болады. Мұ ндағ ы b молекулалардың алып тұ рғ ан кө лемін береді. Ол молекулалардың тө рт еселенген
тең болады. Мұ ндағ ы b молекулалардың алып тұ рғ ан кө лемін береді. Ол молекулалардың тө рт еселенген 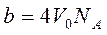 меншікті кө леміне тең. Егер ыдыс ішінде екі молекула орналасса, онда олардың кез-келгені екінші молекуланың ортасына (центріне) a-молекула диаметрінен кіші аралық қ а жақ ындай алмайды. Олай болса, екі молекуланың арасында радиусы d -ғ а тең болатын сфералық бос кө лем пайда болады.
меншікті кө леміне тең. Егер ыдыс ішінде екі молекула орналасса, онда олардың кез-келгені екінші молекуланың ортасына (центріне) a-молекула диаметрінен кіші аралық қ а жақ ындай алмайды. Олай болса, екі молекуланың арасында радиусы d -ғ а тең болатын сфералық бос кө лем пайда болады.
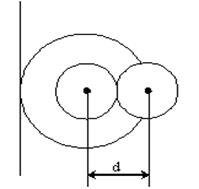
3-cурет
Газ молекулаларының арасында пайда болатын тартылыс кү ші газғ а қ осымша қ ысым кү шін туғ ызады. Ол қ ысымды ішкі қ ысым  (мұ ндағ ы Ван-дер-Ваальс тұ рақ тысы,
(мұ ндағ ы Ван-дер-Ваальс тұ рақ тысы, 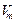 - молярлық кө лем).
- молярлық кө лем).
Сонда 1 моль нақ ты газ молекуласы ү шін жазылғ ан Бойль-Мариот (PV=RT) тең деуін нақ ты газ ү шін Ван-дер-Ваальс
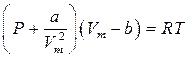 (5)
(5)
ол кез-келген нақ ты газ мө лшері ү шін
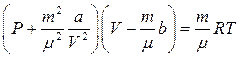 (6)
(6)
мұ ндағ ы: m -газдың массасы, m - мольдік массасы, V -газдың алып тұ рғ ан кө лемі.
Ван-дер-Ваальс тең деуі бағ ынатын газдарды Ван-дер-Ваальс газдары деп атайды.
Ван-дер-Ваальс газының изотермасын P-V диаграммасында қ арастыру ү шін 1 моль нақ ты газ ү шін жазылғ ан (5)-тең деуін пайдаланады. Ван-дер-Ваальс тең деуі V кө лемге қ атысты ү шінші дә режелі тең деу
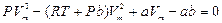 (7)
(7)
Бұ л тең деуге Р қ ысым параметрі ретінде енеді. Тең деудің коэффициенттері нақ ты, заттық (вещественный) болғ андық тан тең деудің бір немесе ү ш тү бірі болады. (заттық немесе бір заттық, екі жорамал тү бірі. Физикалық мағ ынағ а тек заттық тү бірі ғ ана ие.) Ә рбір тү бірі P-V диаграммасында (p=const) изобараның изотерманы қ иып ө тетін нү ктесі сә йкес келеді.