
Главная страница Случайная страница
КАТЕГОРИИ:
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Натрия хлорид и хлороводородная кислота. К 1 капле ЛФ на предметном стекле добавляют 1 каплю раствора пикриновой кислоты и выпаривают досуха
|
|
На Na+:
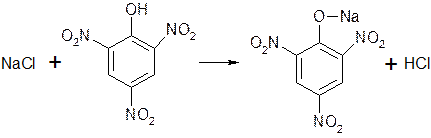 |
К 1 капле ЛФ на предметном стекле добавляют 1 каплю раствора пикриновой кислоты и выпаривают досуха. Желтые игольчатые рассматривают под микроскопом.
На Cl-: К 2-3 каплям ЛФ прибавляют 1 мл воды очищенной, 5-6 капель разведенной кислоты азотной и 2-3 капли раствора серебра нитрата. Образуется белый творожистый осадок.
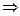 NaCl + AgNO3 AgCl + NaNO3
NaCl + AgNO3 AgCl + NaNO3
Выпадает белый творожистый осадок, который легко растворим в разбавленном растворе аммония гидроксида.
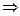 AgCl + 2NH4OH [Ag(NH3)]Cl + 2H2O
AgCl + 2NH4OH [Ag(NH3)]Cl + 2H2O
КОЛИЧЕСТВЕННОЕ ОПРЕДЕЛЕНИЕ:
Кислота хлористоводородная, анализ производится методом нейтрализации (алкалиметрия). Этот метод основан на образовании нейтрального продукта под действием стандартного раствора натрия гидроксида.
К 1 мл исследуемого раствора прибавляют 1 каплю метилового оранжевого и титруют 0, 1 М раствором натрия гидроксида до желтой окраски.
 HCl + NaOH NaCl + H2O, Fэкв=1
HCl + NaOH NaCl + H2O, Fэкв=1
М.м. экв.HCl = М.м.HCl . Fэкв.= 1 . 36, 46=36, 46г/моль
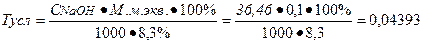
Т.к. для изготовления стабилизатора Вейбеля используется разбавленная кислота хлористоводородная, то используют условный титр.
Расчет теоретического объема титранта на 1 мл аликвоты раствора:
В 1000 мл раствора - 4, 4 мл кислоты хлороводородной
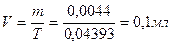 |
1 мл - 0, 0044 мл
На титрование ушел 0, 1мл 0, 1М раствора натрия гидроксида, соответственно содержание исследуемого вещества в граммах равно:
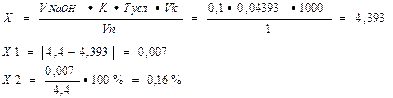
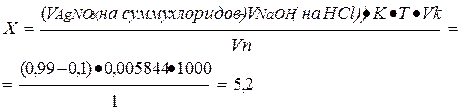
Ошибка не превышает допустимое приказом № 305 отклонение для массы навески от 2, 0 до 5, 0 (4%).
Натрия хлорид (аргентометрически методом Мора). Метод основан на способности натрия хлорида реагировать с серебра нитратом с образованием серебра хлорида.
К 1 мл ЛФ прибавляют 1 каплю хромата калия и титруют 0, 1 моль/л раствором серебра нитрата до оранжево-желтого цвета.
NaCl + AgNO3 → AgCl↓ бел. + NaNO3
В т.к.т. 2 AgNO3 + K2CrO4 → Ag2CrO4↓ Кирп. красн + 2KNO3
f = 1
T = 0, 1*58, 44/1000 = 0, 005844
5, 2 – 1000
х - 1мл; аф=0, 0052
Vтеор. = аф / T = 0, 0052/0, 005844 = 0, 89
Vпр=0, 78
На титрование ушло 0, 99 мл 0, 1М раствора кислоты хлористоводородной, т.е. оттитровалась сумма хлоридов. Т.к. фактор эквивалентности в обоих случаях равен 1, то соответственно содержание натрия хлорида в граммах:
Расчет отклонения:
Относит.ошибка: 0% (по П №305 допустимо 3%).
Заключение: Данная лекарственная форма приготовлена удовлетворительно