
Главная страница Случайная страница
КАТЕГОРИИ:
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Дата: 03.04.13
|
|
Пропись № 1 Rp: Sol. Natrii bromidi 3% – 200 ml
Натрия бромид 6, 0
Вода очищенная 200 мл
Описание: Бесцветная, прозрачная жидкость, без запаха и механических примесей. Общий объем 200 мл.
ОПРЕДЛЕНИЕ ПОДЛИННОСТИ:
Натрия бромид. К 0, 5 мл ЛФ прибавляют 5-6 капель разведенной кислоты азотной и 2-3 капли раствора серебра нитрата. Образуется светло-желтый творожистый осадок.
NaBr + AgNO3 → AgBr↓ светло-желт. + NaNO3
КОЛИЧЕСТВЕННОЕ ОПРЕДЕЛЕНИЕ:
Натрия бромид (Рефрактометрически). Метод основан на способности исследуемого вещества изменять показатель преломления света.
Испытуемый раствор и очищенную воду выдержали 30 минут рядом с рефрактометром для уравнивания температуры. После этого нанесли 3 капли воды на призму рефрактометра и определили показатель преломления. Затем призму тщательно протерли, нанесли 3 капли испытуемого раствора и определили показатель преломления.
Натрия бромид n=1, 3370
Вода очищенная n0=1, 3330
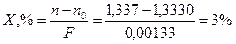 |
(Относит.ошибка=0%).
Заключение: Данная лекарственная форма приготовлена удовлетворительно.
Пропись № 2 Rp: Sol. Ringeri 400, 0 Раствор Рингера 400 № 28
D.t.d. N 28
Состав:
Natrii chloridi 99, 0 Натрия хлорид 99, 0
Kalii chloridi 2, 2 Калия хлорид 2, 2
Calcii chloridi 2, 2 Кальция хлорид 2, 2
Natrii hydrocabonatis 2, 2 Натрия гидрокарбонат 2, 2
Aquae purificatae ad 11000 мл Вода очищенная до 11000 мл
М.м. NaCl = 58, 44
М.м. KCl = 74, 56
М.м.CaCl2=219, 08
М.м. NaHCO3= 83, 99
Описание: на анализ поступила бесцветная прозрачная жидкость без механических включений во флаконе из бесцветного прозрачного стекла.
ОПРЕДЛЕНИЕ ПОДЛИННОСТИ:
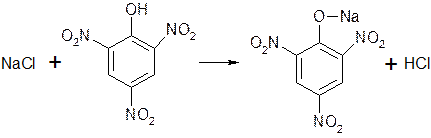 На Na+:
На Na+:
К 1 капле ЛФ на предметном стекле добавляют 1 каплю раствора пикриновой кислоты и выпаривают досуха. Желтые игольчатые рассматривают под микроскопом.
На Cl-: К 2-3 каплям ЛФ прибавляют 1 мл воды очищенной, 5-6 капель разведенной кислоты азотной и 2-3 капли раствора серебра нитрата. Образуется белый творожистый осадок.
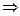 NaCl + AgNO3 AgCl + NaNO3
NaCl + AgNO3 AgCl + NaNO3
Выпадает белый творожистый осадок, который легко растворим в разбавленном растворе аммония гидроксида.
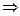 AgCl + 2NH4OH [Ag(NH3)]Cl + 2H2O
AgCl + 2NH4OH [Ag(NH3)]Cl + 2H2O
На К+:
Реакция с раствором натрия (III) гексанитрокобальтата.
1-2 капли раствора, помещенного на предметное стекло, подкисляют уксусной кислотой и прибавляют 2 капли раствора натрия (III) гексанитрокобальтата Образуется желтый кристаллический осадок.
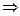 Na3[Co(NO2)6] + 2 KСl K2Na[Co(NO2)6] + 2 NaCl
Na3[Co(NO2)6] + 2 KСl K2Na[Co(NO2)6] + 2 NaCl
На Сa2+: реакция с аммония оксалатом
К 2 мл раствора прибавляют 3-5 капель аммония оксалата. Постепенно образуется белый осадок, нерастворимый в разведенной хлороводородной или азотной кислоте.
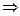 СаCl2 + (NH4)2С2О4 Са С2О4 + 2NH4Cl
СаCl2 + (NH4)2С2О4 Са С2О4 + 2NH4Cl
На HCO3-:
Реакция с хлористоводородной кислотой:
К 2-3 каплям раствора прибавляют 0, 5 мл разведенной кислоты хлористоводородной, при этом появляются пузырьки газа.
 NaHCO3 + HCl NaCl + CO2 + H2O
NaHCO3 + HCl NaCl + CO2 + H2O
КОЛИЧЕСТВЕННОЕ ОПРЕДЕЛЕНИЕ:
Определение суммы хлоридов производится методом аргентометрии (метод Мора), основанном на образовании малодиссоциируемых галогенитов серебра под действием стандартного раствора серебра нитрата.
К 0, 5 мл исследуемого раствора прибавляют 1 каплю калия хромата и титруют 0, 1М раствором серебра нитрата до образования оранжево-коричневого окрашивания.
 NaCl + AgNO3 AgCl + NaNO3 Fэкв NaCl =1
NaCl + AgNO3 AgCl + NaNO3 Fэкв NaCl =1
 СаСl2 + 2AgNO3 2AgCl + Са(NO3)2 Fэкв СаСl2=1/2
СаСl2 + 2AgNO3 2AgCl + Са(NO3)2 Fэкв СаСl2=1/2
 КCl + AgNO3 КCl + NaNO3 Fэкв КCl =1Fэкв СаСl2=1/2
КCl + AgNO3 КCl + NaNO3 Fэкв КCl =1Fэкв СаСl2=1/2
 2АgNO3+K2CrO4 2KNO3+ Ag2CrO4
2АgNO3+K2CrO4 2KNO3+ Ag2CrO4
М.м. экв.NaCl = М.м. NaCl . Fэкв.= 1 . 58, 44=58, 44 г/моль
М.м. экв.КCl = М.м. КCl . Fэкв.= 1 . 74, 56=74, 56 г/моль
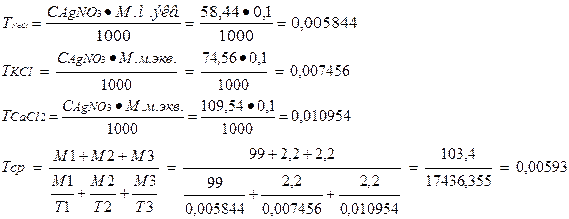 М.м. экв.СаСl2 = М.м.СаСl2 . Fэкв.= 1/2 . 219, 08=109, 54 г/моль
М.м. экв.СаСl2 = М.м.СаСl2 . Fэкв.= 1/2 . 219, 08=109, 54 г/моль
г/мл
Расчет теоретического объема титранта:
Т.к. 103, 4 грамма суммы хлоридов содержится в 11000 мл раствора, то в 0, 5 мл содержится 0, 0047 грамма.
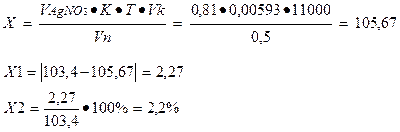
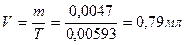 |
На титрование ушло 0, 81 мл 0, 1М раствора серебра нитрата, соответственно содержание натрия хлорида в граммах:
Ошибка не превышает допустимое приказом № 305 отклонение для массы навески свыше 5, 0 (3%).
Кальция хлорида производится с помощью метода трилонометрии, основанном на образовании растворимых в воде комплексов между раствором трилона Б и ионами металлов, которые более прочные, чем окрашенные комплексы ионов металлов с индикатором.
К 5 мл исследуемого раствора прибавляют 5 мл аммиачного буферного раствора и несколько крупинок смеси кислотного хром-темно-синего и титруют 0, 05М раствором Трилона Б до перехода окраски от вишнево-красной до сине-фиолетовой.
Fэкв. СаСl2 = 1/2
М.м. экв.. СаСl2 = М.м.. СаСl2 . Fэкв. = 1/2 . 219, 08 =109, 54 г/моль
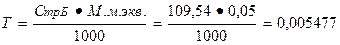 |
Расчет теоретического объема титранта:
Т.к. 2, 2 грамма кальция хлорида содержится в 11000 мл раствора, то в 5 мл содержится 0, 001 грамма.
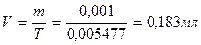 |
На титрование ушло 0, 18мл 0, 05М раствора трилона Б, соответственно содержание исследуемого вещества в граммах равно:

Ошибка не превышает допустимое приказом № 305 отклонение для массы навески свыше 2 до 5 (4%).
Натрия гидрокарбонат, анализ производится с помощью метода ацидиметрии, основанном на образовании нейтральных продуктов под действием стандартного раствора хлористоводородной кислоты на вещество основного характера.
К 5 мл исследуемого раствора прибавляют 1 каплю метилового красного и титруют 0, 1М раствором хлористоводородной кислоты до красного окрашивания.
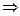 NaHCO3 + HCl NaCl + CO2 + H2O
NaHCO3 + HCl NaCl + CO2 + H2O
Fэкв.NaHCO3= 1
М.м. экв. NaHCO3= М.м NaHCO3 . Fэкв. = 1 . 83, 99 =83, 99 г/моль
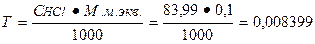 |
Расчет теоретического объема титранта:
Т.к. 2, 2 грамма натрия гидрокарбоната содержится в 11000 мл раствора, то в 5 мл содержится 0, 001 грамма.
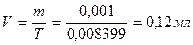 |
На титрование ушло 0, 12мл 0, 1М раствора хлористоводородной кислоты, соответственно содержание исследуемого вещества в граммах равно:
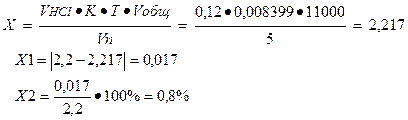
Ошибка не превышает допустимое приказом № 305 отклонение для массы навески свыше 2 до 5 (4%).
Вывод: ЛФ приготовлена удовлетворительно.