
Главная страница Случайная страница
КАТЕГОРИИ:
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Билет 2
|
|
1) Кремнегалогены: классификация кремнегалогенов, методы синтеза простых и комплексных кремнегалогенов, их свойства и применение.
Названия галогенпроизводных силана складываются из названия числа замещающих водород атомов галогена (моно-, ди-, три-, тетра-), наименования галогена и силана.
Эти соединения устойчивы.
Простые кремнегалогены: можно рассматривать как производные силанов. Они разделяются на простые полностью замещенные и простые частично замещенные кремнегалогены. Практическое значение имеют SiF4, SiCl4, SiBr4, SiI4. Общий способ получения – непосредственное взаимодействие элементарного кремния с соответствующим галогеном: Si + 2Hal = Si(Hal)4. Фтор реагирует при обычной температуре, остальные – при нагревании.
• Агрегатное состояние полностью замещенных кремнегалогенов меняется меняется в зависимости от вида кремнегалогена:
SiF4 – ядовитый газ бесцветный газ
SiCl4, SiBr4 – бесцветные жидкости
SiI4 – белое кристаллическое вещество.
• Сами по себе устойчивы, но при обычной температуре разлагаются водой (обусловлено значительным сродством кремния к кислороду). Устойчивость к воде возрастает в ряду от SiI4 до SiF4.
• SiF4 получается действием избытка концентрированной серной кислоты на смесь тонко измельченного кварцевого песка и плавикового шпата или нагреванием кварцевого песка с плавиковой кислотой:
SiO2 + 2H2SO4 + 2CaF2 = 2CaSO4 + 2H2O + SiF4
SiO2 + 4HF = SiF4 + 2H2O
SiF4 хорошо растворим в воде, с образованием кремнефтористой кислоты. Используется в лабораторной практике для исследований.
• SiCl4 получают нагреванием элементарного кремния или силицида магния в струе хлора:
Si + 2Cl2 = SiCl4
Mg2Si + 4Cl2 = SiCl4 + 2MgCl2
В технике получают путем нагревания смеси кварцевого песка и угля в струе хлора:
SiO2 + 4Cl2 = SiCl4 + 2CO
Легко разлается водой с образованием HCl и геля SiO2. Вследствие этого пары SiCl4 дымят на влажном воздухе.
Реагирует с оксидами большинства металлов: 3SiCl4 + 2Al2O3 = 3SiO2 + 4SlCl3
Исходный материал для синтеза кремнийорганических соединений и получения силицидных покрытий металлов. Дымовых завес.
• SiBr4 – по способам получения и свойствам близок к SiCl4.
- Совместное нагревание элементарного кремния с парами брома при температуре до 500С.
- Взаимодействие газообразного HBr с парами SiCl4: SiCl4 + 4HBr = SiBr4 + 4HCl
• SiI4 получают при пропускании смеси паров иода с углекислотой над раскаленным элементарным кремнием или при взаимодействии газообразного HI с парами SiCl4: SiCl4 + 4HI = SiI4 + 4HCl
- легкая воспламеняемость нагретых паров: SiI4 + O2 = 2I2 + SiO2
Простые частично замещенные кремнегалогены
Представители SiHF3, SiHCl3, SiHBr3, SiHI3
В промышленности SiHCl3 получают действием паров HCl на нагретый до 200С ферросилицид:
FeSi + 5HCl = SiHCl3 + 2FeCl2 + 2H2
- силикохлороформ легко загорается на воздухе:
2SiHCl3 + 2O2 = 2SiO2 + H2 6 3Cl2
- гидролизуется водой с образованием SiO2 и HCl
Комплексные соединения кремния
Это производные кремнефтористой кислоты. Кислота образуется при:
- Взаимодействии 2HF + SiF4 = H2SiF6
- Получение водного раствора: 3SiF4 + 3H2O = H2SiF6
- Побочный продукт при производстве суперфосфата: при обработке апатитов, фосфоритов серной кислотой выделяется SiF4
Это сильная кислота, устойчива в водных растворах. Кажущаяся степень диссоциации в 1н р-ре 53%. Обладает сильными дезинфицирующими свойствами. Применение для стерилизации емкостей в пищевой промышленности.
Кремнефториды. Соли кремнефтористой кислоты.
H2SiF6 + 2KCl = K2SiF6 + 2HCl
Соли щелочных металлов (кроме лития) трудно растворимы в воде. Соли разлагаются едкими и углекислыми щелочами.
Na2SiF6 используется в качестве глушителя, антисептика для пропитки древесины, в производстве зубных цементов и для ускорения схватывания кислотоупорных огнеупоров на основе жидкого стекла. Хорошо растворимые кремнефториды (MgSiF6*6H2O, ZnSiF6*6H2O) используются для флюатирования.
2) Диаграмма состояния системы CaO-Al2O3-SiO2. Тройные соединения в системе: их краткая характеристика, распространение в природе и технических продуктах. Значение системы для химии и технологии силикатов. Области составов технических продуктов на диаграмме.
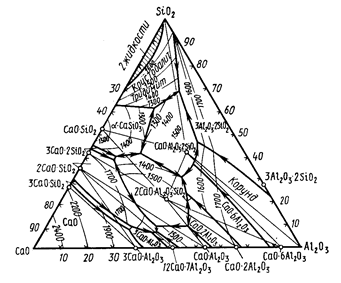
В системе существует много химических соединений, в т.ч. 2 тройных:
Анортит – CaO*Al2O3*2SiO2 плавится без разложения при 1550С. Существуют данные о трех модификациях анортита – триклинной, ромбической (метастабильная форма при всех температурах) и гексагональной (стабилен до 300С). Широко распространен в природе преимущественно в виде твердых растворов с альбитом (Na2O*Al2O3*6SiO2) – плагиоклазы.
Геленит – 2CaO*Al2O3*SiO2 – плавится без разложения при 1590С. Не имеет полиморфных разновидностей. Встречается в природе в виде неограниченных твердых растворов с окерманитом 2CaO*MgO*2SiO2, называемые мелилитами.
При высоких давлениях в системе существуют еще содиниения:
Гроссуляр – 3CaO*Al2O3*3SiO2 and пироксен – CaO*Al2O3*SiO2, при обычном давлении не имеют областей стабильного существования на диаграмме.
Области составов технических продуктов
Выделены области, соответствующие применяемым в технике составам различных технических продуктов.
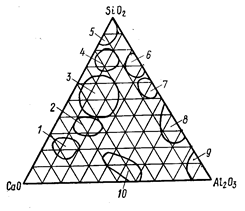
1 – портланцемент; 2 – основные шлаки; 3 – кислые щлаки; 4 – стекло; 5 – динасовые огнеупоры; 6 – фарфор; 7 – шамотные огнеупоры; 8 – муллитовые огнеупоры; 9 – корунд; 10 – глиноземистый цемент.