
Главная страница Случайная страница
КАТЕГОРИИ:
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Билет 3. 1) Карбид кремния: особенности структуры, получение, свойства и применение
|
|
1) Карбид кремния: особенности структуры, получение, свойства и применение. Политипизм: сущность этого явления и примеры его проявления в кристаллических соединениях.
Получение:
• восстановление кремнезема углеродистыми материалами (уголь, кокс, графит, сажа). Реакция в две стадии:
- SiO2 + 2C = Si(парообразный) + 2CO;
- Si + C = SiC;
SiO2 + 3C = SiC + 2CO
Получают в электрических печах с угольными электродами при Т = 1800-2000С. Шихта для получения: 50-55 мас% SiO2; 35-40% мелкоизмельченного кокса или антрацита; 5-10% древесных опилок (для придания пористости спекающейся массе – облегчение удаления газообразных продуктов); 1-5% NaCl – удаление примесей Al2O3, Fe2O3, TiO2 – образуют летучие хлориды.
Различают два карбида кремния: кристаллический (черного цвета из-за равномерно распределенного углерода) и аморфный (тонкодисперсный серо-зеленого цвета). После сортировки – помол, промывка в воде и слабой серной кислоте, электромагнитная сепарация для отделения металлического железа.
Свойства:
• имеет плотно упакованную структуру. (ПУ создают атомы Si, а пустотах атомы С) Кристаллическую структуру можно представить как состоящую из слоев, образованных тетраэдрическими группами [SiC4], [CSi4], чередующиеся между собой.
• твердость по Моосу 9, 5-9, 75; повышенная хрупкость
• высокая теплопроводность и низкий КТР, высокая термостойкость и огнеупорность (~2500C)
• не имеет определенной температуры плавления. Диссоциирует при высокой температуре: SiC = Si + C с возгонкой кремния.
• технический SiC из-за наличия примесей элементарного Si обладает электропроводностью, которая растет с повышением температуры.
• высокая химическая стойкость и малая реакционная способность при высоких и низких температурах. Кислородом воздуха и парами воды окисляется при ~1700-1750C. Кислоты не действуют (кроме ортофосфорной). Разложение происходит в смеси концентрированной азотной и плавиковой, в ортофосфорной (получается SiO2).
• разлагается расплавленными и углекислыми щелочами в присутствии воздуха с образованием силикатов:
SiC + 2NaOH + 2O2 = Na2SiO3 + H2O + CO2
• газы – H2, O2, N2, CO2 при температурах ниже 1000С не действуют. Взаимодействует с галогенами:
SiC + 2Cl2 (при 100C) = SiCl4 + C
Применение:
• получение высокоогнеупорных карборундовых изделий («рефракс», «карбофракс»), применяемые в цветной металлургии.
• производство абразивных материалов.
• нагревательные элементы сопротивления в электрических печах (силит, глобар).
• изготовление вентильных разрядников, электросопротивление которых уменьшается при увеличении напряжения в цепи. Их в виде дисков применяют для борьбы с высоким напряжением в высоковольтных сетях.
Политипизм – это случай полиморфизма, заключающийся в том, что вещество может кристаллизоваться в нескольких формах, отличающихся типом упаковки атомов в структуре. Элементарная ячейка α -SiC (гексагональная) имеет параметры: a=b=0.308 нм, c=0.252n нм, где n – число слоев в ячейке политипа в направлении оси с. n = 2-500. Наиболее известный – шестислойный политип.
2) Диаграмма состояния системы MgO-CaO-SiO2. Характеристика тройных соединений в этой системе. Их распространение в природе и технических продуктах, твердые растворы между соединениями в этой системе. Значение системы для химии и технологии силикатов.
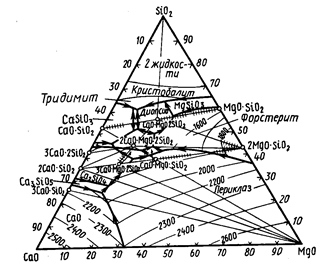
Система называется шлаковой.
Монтичелит CaO*MgO*2SiO2 – плавится инконгруэнтно при 1485С, разлагаясь на жидкость и периклаз (MgO). Встречается в природе в виде минерала того названия. В технических продуктах – в основных доменных шлаках, в составе связок магнезиальных огнеупоров.
Мервинит 3CaO*MgO*2SiO2 – плавится инконгруэнтно при 1575С, разлагаясь на жидкость, 2 CaO*SiO2 и по некоторым данным MgO. Известен как природный минерал, встречается в технических продуктах (шлаки, доломитовые огнеупоры).
Окерманит 2CaO*MgO*2SiO2 – плавится конгруэнтно при 1454. Встречается в природе и некоторых технических продуктах, в основном в доменных шлаках цветной металлургии.
Диопсид CaO*MgO*2SiO2 плавится конгруэнтно при1390С. В природе распространен как минерал пироксеновой группы в виде твердых растворов с MgO*SiO2.
Особенность: образование между многими соединениями твердых растворов.
Система имеет значение для продуктов: доломитовых огнеупоров, магнезиальных портландцементов, магнезиальных керамических масс, металлургических шлаков, ситаллов и т.п.