
Главная страница Случайная страница
КАТЕГОРИИ:
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
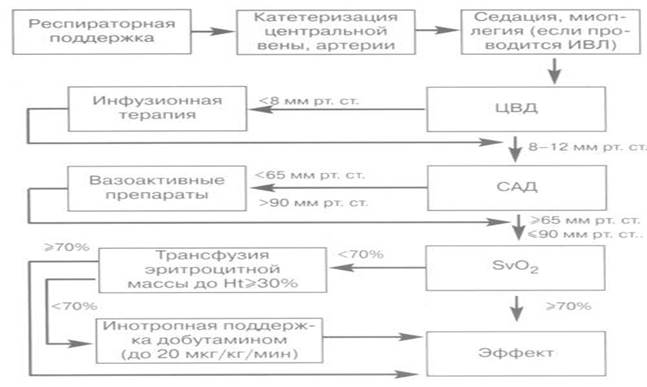
Алгоритм ранней целенаправленной терапии
|
|
Кортикостероиды
Показания:
Ø Начальная стадия септического шока при одномоментном поступлении инфекта в кровь (введение инфицированных трансфузионных сред).
Ø Променение высоких доз катехоламинов, рефрактерный септический шок.
Гидрокортизон 240-300мг в первые сутки. После стабилизации давления доза может быть снижена до 50 мг каждые 8 часов последующие 48 часов. Длительность терапии – 5-7 суток
Применение глюкокортикоидов при отсутствии СШ и/или признаков адреналовой недостаточности на фоне сепсиса необоснованно.
Иммуноглобулины и иммуномодуляторы
Целесообразность включения внутривенных иммуноглобулинов(IgG и IgG+IgM) (категория доказательности А) связана с их возможностью ограничивать избыточное действие провоспалительных цитокинов, повышать клиренс эндотоксина и стафилококкового суперантигена, устранять анергию, усиливать эффект b-лактамных антибиотиков. Использование внутривенных иммуноглобулинов в рамках иммунозаместительной терапии тяжелого сепсиса и СШ является в настоящее время единственным реально доказанным методом иммунокоррекции при сепсисе, повышающим выживаемость Наиболее оптимальные результаты при использовании иммуноглобулинов получены в раннюю фазу шока (" теплый шок") и у пациентов с тяжелым сепсисом и диапазоном индекса тяжести по АРAСНЕ II – 20–25 баллов (категория доказательности С).
Ø Пентаглобин (IgG и IgM):
· в первые сутки по 5-8 мл/кг;
· двое суток по 4 мл/кг в течение 12 часов.
Ø Интраглобин (IgG) в дозе 2-5 мл/кг на протяжении 2-3 суток.
Ø Ронлейкин в дозе 1-2 млн. МЕ в сочетании с 4-8 мл 10% раствора альбумина. Длительность инфузии составляет 4-5 часов.
Нутритивная поддержка
Развитие синдрома ПОН при сепсисе, как правило, сопровождается проявлениями гиперметаболизма. В этой ситуации покрытие энергетических потребностей происходит за счет деструкции собственных клеточных структур (аутоканнибализм), что усугубляет имеющуюся органную дисфункцию и усиливает эндотоксикоз. Поэтому проведение искусственной питательной поддержки является крайне важным компонентом лечения и входит в комплекс обязательных лечебных мероприятий.
Нутритивная поддержка рассматривается в качестве метода, предотвращающего развитие тяжелого истощения (белково-энергетической недостаточности) на фоне выраженного гиперкатаболизма и гиперметаболизма, являющихся наиболее характерными метаболическими характеристиками генерализованной воспалительной реакции инфекционного происхождения. Включение энтерального питания в комплекс интенсивной терапии предупреждает транслокацию микрофлоры из кишечника, развитие дисбактериоза, повышает функциональную активность энтероцита и защитные свойства слизистой оболочки, снижая степень эндотоксикоза и риск возникновения вторичных инфекционных осложнений.
При проведении нутритивной поддержки целесообразно ориентироваться на следующие рекомендации (категория доказательности С):
Ø Энергетическая ценность – 25–35 ккал/кг/24 ч – острая фаза
Ø 35–50 ккал/кг/24 ч – фаза стабильного гиперметаболизма
Ø Глюкоза – < 6 г/кг/24 ч
Ø Липиды – 0, 5–1 г/кг/24 ч
Ø Белки – 1, 2–2, 0 г/кг/24 ч (0, 20–0, 35 г азота/кг/24 ч), тщательный контроль за азотистым балансом
Ø Витамины – стандартный суточный набор + К (10 мг/24 ч) + В1 и В6 (100 мг/24 ч) + А, С, Е
Ø Микроэлементы – cтандартный суточный набор + Zn (15–20 мг/24 ч + 10 мг/л при наличии жидкого стула)
Ø Электролиты – Na+, K+, Ca2+ соответственно балансным расчетам и концентрации в плазме + P2+ (> 16 ммоль/24 ч) + Mg2+ (> 200 мг/24 ч)
Раннее начало нутритивной поддержки в сроки 24–36 ч более эффективно, чем с 3–4-х суток интенсивной терапии. Особенно это касается протоколов раннего и позднего начала энтерального зондового питания (категория доказательности В).
Раннее энтеральное питание рассматривается как более дешевая альтернатива полному парентеральному питанию.
Выбор метода нутритивной поддержки зависит от степени выраженности питательной недостаточности и состояния функций желудочно-кишечного тракта (ЖКТ) – пероральный прием энтеральных диет, энтеральное зондовое питание, парентеральное питание, парентеральное + энтеральное зондовое питание.
Пероральный прием энтеральных смесей (сиппинг в виде напитка в сочетании с естественным питанием) применяют в тех ситуациях, когда больной может питаться самостоятельно через рот, но потребности в белковых и энергетических нутриентах высокие или больной не может усвоить весь объем лечебного рациона. В качестве смесей энтерального питания, по показаниям, могут быть использованы стандартные полимерные смеси высокой питательной плотности. Средний суточный объе готовой смеси – 500–1000 мл (1 мл = 1 ккал). Доля энтерального питания в суточном рационе составляет от 25 до 75%. Адаптация больного к смесям проводится постепенно в течение 2–3 дней с увеличением суточной дозы на 50–100 мл.
В условиях, когда функции ЖКТ сохранены, но нарушены акт глотания и сознание, внутрижелудочное зондовое питание сбалансированными рационами полностью обеспечивает энергетические и пластические потребности организма в условиях повышенных энерготрат.
При структурных и функциональных нарушениях ЖКТ применяют внутрикишечное введение питательной смеси. В зависимости от степени кишечной недостаточности на первом этапе применяют полуэлементные (олигопептидные) смеси в возрастающей концентрации 10–15–20%, объемом до 2000–3000 мл. По мере восстановления основных функций ЖКТ переходят на энтеральное введение стандартной смеси в тех же объемах и концентрации.
Для эффективного синтеза эндогенного белка важно соблюдение метаболического соотношения небелковые калории/общий азот в диапазоне 1 г азота к 110–130 ккал. Углеводы не должны вводиться в дозе более 6 г/кг/сут в связи с тем, что существует риск развития гипергликемии и активации процессов катаболизма в скелетных мышцах. При парентеральном введении жировых эмульсий рекомендуется режим круглосуточного введения. Необходимо отдавать предпочтение жировым эмульсиям II поколения типа МСТ/ЛСТ, которые демонстрируют более высокую скорость утилизации из кровеносного русла и окисления у больных с тяжелым сепсисом (категория доказательности С).
Противопоказания к нутритивной поддержке:
1. Рефрактерный шок (доза допамина более 15 мкг/кг/мин и САД< 90 мм рт. ст.).
2. Непереносимость сред для проведения нутритивной поддержки.
3. Тяжелая некупируемая артериальная гипоксемия.
4. Некорригированная гиповолемия.
5. Декомпенсированный метаболический ацидоз.
Контроль гликемии
Важным аспектом комплексной ИТ тяжелого сепсиса является постоянный контроль уровня гликемии и инсулинотерапия. Высокий уровень гликемии и необходимость в инсулинотерапии являются факторами неблагоприятного исхода у больных с диагностированным сепсисом (категория доказательности С). В этой связи необходимо стремиться к поддержанию уровня гликемии в пределах 4, 5–6, 1 ммоль/л. При уровне гликемии более 6, 1 ммоль/л должна проводиться инфузия инсулина (в дозе 0, 5–1 ЕД/ч) для подержания нормогликемии (4, 4–6, 1 ммоль/л). Контроль концентрации глюкозы – каждые 1–4 ч в зависимости от клинической ситуации. При выполнении данного алгоритма регистрируется статистически значимое повышение выживаемости (категория доказательности В).
Ограничение медиаторного «взрыва»
Большое количество работ посвящено хорошо известному и широко применяемому в клинической практике препарату пентоксифиллину (трентал, пентилин). Пентоксифиллин потенцирует антивоспалительное действие аденозина, простациклина и простагландинов класса Е за счет синергизма при воздействии на циклическую АМФ. Благодаря этому механизму пентоксифиллин ингибирует выработку свободных радикалов полиморфноядерными нуклеарами, агрегацию тромбоцитов и снижает плазменную концентрацию фактора некроза опухоли и интерлейкина-6.
Ø Пентоксифиллин в дозе 100-300 мг.
Ø Гордокс в дозе 200-400 КИЕ.
Ø Контрикал по 80000-150000 Ед в сутки.
Ø Тразилол 125000-200000 Ед в сутки
Воздействие на свободные кислородные радикалы и перекисное окисление липидов
Ø Аскорбиновая кислота до 1, 0 г в сутки;
Ø Олифен 140-280 мг в сутки.
Коррекция нарушений микроциркуляции и профилактика тромбоза глубоких вен
Ø Реополиглюкин в дозе 400-800 мл в сутки;
Ø Дипиридамол в дозе 50-100 мг 2-3 раза в день;
Ø Компламин в дозе 300-600 мг внутривенно капельно;
Ø Гепаринотерапия внутривенно в сочетании со свежезамороженной плазмой, суточная доза – 300 Ед/кг массы тела больного.
Имеющиеся данные в настоящее время подтверждают, что профилактика тромбоза глубоких вен существенно влияет на результаты лечения больных с сепсисом (категория доказательности А). C этой целью могут использоваться как нефракционированный гепарин, так и препараты низкомолекулярного гепарина. Главными преимуществами препаратов низкомолекулярного гепарина являются меньшая частота геморрагических осложнений, менее выраженное влияние на функцию тромбоцитов, пролонгированное действие, т.е. возможность однократного введения в сутки.
Активированный протеин С (дротрекогин-a активированный)
Одними из характерных проявлений сепсиса являются нарушения системной коагуляции (активация коагуляционного каскада и угнетение фибринолиза), которые итоге приводят к гипоперфузии и органной дисфункции. Воздействие активированного протеина С (АПС) на систему воспаления реализуется через несколько механизмов:
Ø снижение присоединения селектинов к лейкоцитам, что сопровождается предохранением цельности сосудистого эндотелия, играющего важнейшую роль в развитии системного воспаления;
Ø снижение высвобождения цитокинов из моноцитов;
Ø блокирование высвобождения TNF-a из лейкоцитов;
Ø ингибирование выработки тромбина, который потенцирует воспалительный ответ.
Антикоагулянтное, профибринолитическое и противовоспалительное действие AПC обусловлено:
Ø деградацией факторов Va и VIIIa, что ведет к подавлению тромбообразования;
Ø активацией фибринолиза за счет подавления PAI-1 (ингибитора активатора плазминогена);
Ø прямым противовоспалительным эффектом на эндотелиальные клетки и нейтрофилы;
Ø защитой эндотелия от апоптоза.
Введение АПС (дротрекогин-a активированный, зигрис) в дозировке 24 мкг/кг/ч в течение 96 ч снижает риск летального исхода на 19, 4% (категория доказательности А).
Профилактика образования стресс-язв ЖКТ
Это направление играет существенную роль в благоприятном исходе при ведении больных с тяжелым сепсисом и СШ, так как летальность у больных с кровотечениями из стресс-язв ЖКТ колеблется от 64 до 87%. Частота возникновения стресс-язв без применения их профилактики у больных в критическом состоянии может достигать 52, 8%. Профилактическое применение блокаторов Н2-рецепторов и ингибиторов протонной помпы в 2 раза и более снижает риск осложнений (категория доказательности В). Основное направление профилактики и лечения – поддержание pH выше 3, 5 (до 6, 0). При этом эффективность ингибиторов протонной выше, чем применение H2-блокаторов. Следует подчеркнуть, что помимо указанных препаратов важную роль в профилактике образования стресс-язв играет энтеральное питание.
Другие широко используемые методы
Ø Гемосорбция.
Ø Плазмоферез.
Ø Гемодиализ.
Ø Гемофильтрация.
Ø Внутрисосудистое лазерное и УФ облучение крови
Ø Гипербарическая оксигенация (ГБО)
Экстракорпоральная детоксикация наиболее показана при органной недостаточности.
VIII. Самостоятельная работа студентов