
Главная страница Случайная страница
КАТЕГОРИИ:
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Обратимый изотермический процесс.
|
|
В изотермическом процессе обеспечивается непрерывный подвод тепла к рабочему телу от источника теплоты постоянной температуры.
1. T=const.
2. 
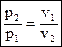 (1.61)
(1.61)
Выражение (1.53) называется законом Бойля-Мариотта и показывает, что давление в изотермическом процессе обратно пропорционально объему.
3. Поскольку dT=0, то  и
и 
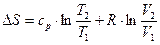 , так как ln
, так как ln  =0 то
=0 то 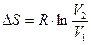 (1.62)
(1.62)
4. 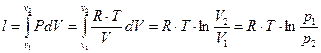 (1.63)
(1.63)
5. Из первого закона термодинамики следует, что подводимая к рабочему телу теплота в процессе T=const идет на совершение работы:
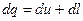 ;
; 
 (1.64)
(1.64)
6. График процесса T=const в pv-координатах изображается равнобокой гиперболой.
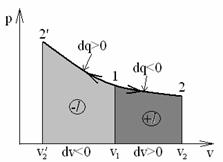
Рис. 1.6 - Процесс изменения состояния идеального газа при T=const на PV- диаграмме
Линия 1-2 – изотермическое расширение газа требует подвода теплоты (dq > 0).
Линия 1-2’: изотермическое сжатие, требует отвода тепла (dq < 0).
Адиабатный процесс идеального газа.
Адиабатный процесс – это процесс, протекающий без подвода и отвода теплоты (q = const), то есть без теплообмена с окружающей средой. При адиабатном изменении состояния газа предполагается, что рабочее тело заключено в теплоизолирующую оболочку.
1.Уравнение адиабаты в системе координат PV имеет вид:
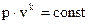 , (1.65)
, (1.65)
где k = 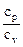 – показатель адиабаты.
– показатель адиабаты.
2.Соотношения между начальными и конечными параметрами газа в адиабатном процессе в соответствии с уравнением (1.4) запишется следующим образом:
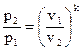 ,
, 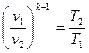 ,
, 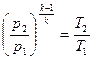 (1.66)
(1.66)
3. Изменение внутренней энергии и энтальпии определяется теми же выражениями, что и для выше рассмотренных процессов, так как внутренняя энергия и энтальпия являются параметрами состояния рабочего тела и не зависит от вида процесса:
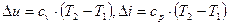
Поскольку процесс протекает без теплообмена с окружающей средой, то энтропия газа не изменяется: ∆ S=0.
4. Аналитическое выражение первого закона термодинамики для адиабатного процесса примет вид: 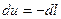 (1.67)
(1.67)
Выражение (1.63) показывает, что работа совершается за счет внутренней энергии рабочего тела. Работе расширения газа или положительной работе (dl> 0) соответствует уменьшение внутренней энергии du< 0 и уменьшение температуры dТ< 0. Работе сжатия (dl< 0) соответствует увеличение внутренней энергии (du> 0) газа и увеличение температуры (dT> 0).
Тогда работа определяется следующим образом:
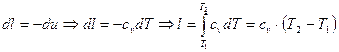 (1.68)
(1.68)
Выражение (1.64) можно представить в другом виде:
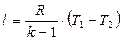 ,
, 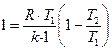 (1.69)
(1.69)
или  (1.70)
(1.70)
При расчетах принимается cv = const.
5. Адиабата на pv – диаграмме изображается более крутой кривой по сравнению с изотермической pv =const (рис.1.7), так как показатель адиабаты k> 1.
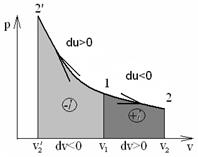

Рис. 1.7 – Адиабатное изменение состояния идеального газа
На рис.1.7 по линии 1-2 адиабатное расширение газа идет с уменьшением внутренней энергии рабочего тела (du< 0), при этом dT< 0; dP< 0 и совершением положительной работы (dl> 0). По линии 1-2′ адиабатное сжатие газа идет с увеличением внутренней энергии рабочего тела (du> 0), при этом dT> 0; dP> 0 с затратой работы (dl< 0).
Политропные процессы.
Политропные процессы характеризуются тем, что они протекают с изменением всех параметров состояния газа при теплообмене с окружающей средой. Уравнение политропы имеет вид:
 (1.71)
(1.71)
где n- показатель политропы.  .
.
Для данного обратимого процесса n=const.рассмотренные выше процессы являются чистыми случаями адиабатного:
При n=0 p=const –изобарный процесс;
n=1 pV=const- изотермический процесс;
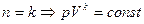 адиабатный процесс;
адиабатный процесс;
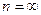 V=const – изохорный процесс
V=const – изохорный процесс
Для политропы справедливы зависимости между параметрами и выражения для работы, аналогичные адиабатному процессу. Остается только заменить показатель адиабаты K на показатель политропы n.
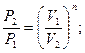
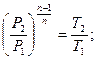
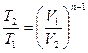 (1.72)
(1.72)
 (1.73)
(1.73)
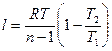 (1.74)
(1.74)
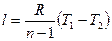 (1.75)
(1.75)
Если количество тепла, участвующее в процессе известно, то работа может быть определена по формуле:
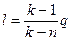 (1.76)
(1.76)
Выражение для удельного количества теплоты в политропном процессе может быть получено следующим образом:
 (1.77)
(1.77)
где 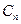 -удельная теплоемкость обратимого политропного процесса, определяется выражением:
-удельная теплоемкость обратимого политропного процесса, определяется выражением:

так как 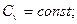 n=const; k=const;
n=const; k=const;
Таким образом, обратимый политропный процесс есть процесс с постоянной удельной теплоемкостью.
Если в выражение для удельной теплоемкости политропного процесса подставить значение n для процессов идеального газа, то получим следующие постоянные значения:
1) 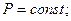
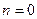
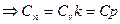
2) V=const; 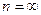
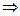
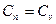
3) T=const n=1 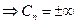
4) 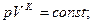 n=k
n=k 
При k> n> 1 удельная теплоемкость отрицательна. Это означает, что в процессах для области указанных значений n изменения dq и dT имеют различные алгебраические значения. Так, при расширении работа совершается за счет подвода теплоты и частично за счет убыли внутренней энергии, то есть падения температуры (dq< dl).
По величине показателя политропы можно определить относительное положение на PV-диаграмме, а также выяснить характер процесса, то есть имеет место подвод или отвод тепла:
а) n< 1 тепло подводится 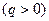 ; внутренняя энергия газа растет.
; внутренняя энергия газа растет.
б) k> n> 1- тепло подводится 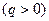 , внутренняя энергия уменьшается
, внутренняя энергия уменьшается  (так как в этом интервале работа расширения совершается за счет подвода тепла и частично за счет убывания внутренней энергии, т.е падения температуры);
(так как в этом интервале работа расширения совершается за счет подвода тепла и частично за счет убывания внутренней энергии, т.е падения температуры);
в) n> k – тепло отводится  , внутренняя энергия уменьшается
, внутренняя энергия уменьшается
1) n< 1 –тепло отводится  ;
;  ;
;
2) k> n> 1-тепло отводится  ;
;  :
:
3) n> k- тепло подводится 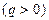 ;
; 
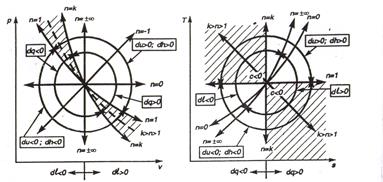
Рис. 1.8 – Политропные процессы на PV-диаграмме, TS-диаграмме.