
Главная страница Случайная страница
КАТЕГОРИИ:
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Исследование термодинамических процессов с идеальным газом.
|
|
Порядок исследования термодинамических процессов.
1. Записывается уравнение процесса в P-V координатах.
2. Выводятся соотношения между параметрами состояния рабочего тела.
3. Определяются изменения внутренней энергии, энтальпии и энтропии.
4. Вычисляется работа деформации газа в процессе.
5. Вычисляется количество теплоты, участвующей в процессе.
6. Процесс изображается на pV диаграммах.
Обратимый изобарный процесс идеального газа.
1. При изобарном процессе давление остается постоянным: p=const
Для проведения обратимого процесса требуется множество источников теплоты разной температуры.
2. Из уравнения состояния идеального газа 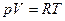 при p=const находим:
при p=const находим: 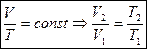 , (1.50)
, (1.50)
Выражение (1.47) называется законом Гей-Люссака, в изобарном процессе объем газа меняется прямо пропорционально температуре.
3. Изменение удельной внутренней энергии определяется одинаково для всех процессов, так как 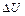 является параметром состояния рабочего тела:
является параметром состояния рабочего тела: 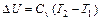 (1.51)
(1.51)
Изменение энтальпии определяется выражением:
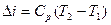 (1.52)
(1.52)
Изменение энтропии в изобарном процессе определяется из формулы (1.49):
 (1.53)
(1.53)
4. Удельная работа расширения или сжатия газа:
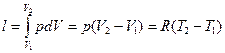 (1.54)
(1.54)
Для M кг газа:
L = M·p(V2-V1)= MR(T2 –T1) (1.55)
5.Определим удельное количество теплоты участвующее в процессе:
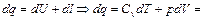
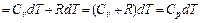
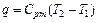 (1.56)
(1.56)
Полная теплота процесса:  (1.57)
(1.57)
6. Графически изобарный процесс в PV координатах изображается горизонтальной прямой (рис. 1.4): линия 1 – 2: изобарное расширение рабочего тела ( ), температура в процессе увеличивается, теплота подводится dq > 0, совершается положительная работа
), температура в процессе увеличивается, теплота подводится dq > 0, совершается положительная работа  .Линия 1-2
.Линия 1-2  : изобарное сжатие (
: изобарное сжатие ( ), здесь температура уменьшается, тепло отводится
), здесь температура уменьшается, тепло отводится 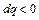 , над системой совершается работа
, над системой совершается работа  .
.
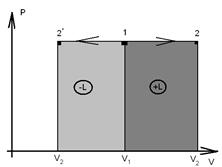
Рис. 1.4 - Процесс изменения состояния идеального газа при P = const на PV-диаграмме.
Обратимый изохорный процесс идеального газа.
1. В данном процессе объем газа остается постоянным: 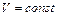 , а два других параметра изменяются:
, а два других параметра изменяются:
2.Выразим соотношение между параметрами из уравнения состояния идеального газа:
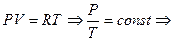
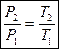 (1.58)
(1.58)
Данное выражение называется Законом Шарля и определяет прямую пропорциональную зависимость между параметрами в изохорном процессе.
3. 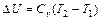 ,
, 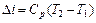
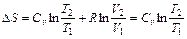
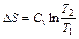 (1.59)
(1.59)
4. В изохорном процессе работа не совершается, так как dV=0
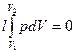 (1.60)
(1.60)
Согласно пераого закона термодинамики ( ) поскольку
) поскольку 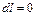 , dq= dU (1.58)
, dq= dU (1.58)
т.е. подводимая или отводимая в процессе теплота идет только на изменение внутренней энергии рабочего тела.
5. 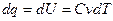 (1.59)
(1.59)  (1.60)
(1.60)
6. График процесса в координатах pV изображается в виде вертикальной прямой (рис. 1.5). Линия 1-2: при подводе теплоты  увеличивается давление и температура:
увеличивается давление и температура: 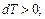
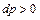 . Линия 1-2
. Линия 1-2  при отводе теплоты (
при отводе теплоты (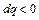 ) уменьшаются температура и давление
) уменьшаются температура и давление 

Рис. 1.5 - Процесс изменения состояния идеального газа при V=const на PV- диаграмме.