
Главная страница Случайная страница
КАТЕГОРИИ:
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Техническая термодинамика
|
|
Название науки «термодинамика» происходит от греческих слов «термос» – тепло и «динамис» – сила. Таким образом, термодинамика – наука, изучающая законы превращения теплоты в работу и наоборот – работы в теплоту. Термодинамика опирается на фундаментальные законы (начала), которые обобщают наблюдения за процессами в природе, независимо от конкретных свойств тел.
Основные понятия термодинамики
Для взаимного превращения теплоты в работу необходимо иметь такое вещество, которое может легко изменять свой объем. Это вещество называется рабочим телом. В качестве рабочего тела применяют различные газообразные вещества.
В термодинамике в качестве рабочего тела используется идеальный газ. Он обладает следующими свойствами:
1) молекулы находятся в постоянном хаотическом движении;
2) отсутствует собственный объем молекул, то есть ничтожно мал по сравнению с межмолекулярным объемом;
3) между молекулами отсутствуют силы взаимодействия.
Объект термодинамического исследования называют системой.
Термодинамическая система – это группа рабочих тел или одно рабочее тело, выделенное для изучения.
Все что не включено в систему, но может взаимодействовать с ней, называется окружающей средой.
В общем случае взаимодействие системы и окружающей среды может состоять в обмене веществом и передаче энергиитеплотой и работой, под которой понимают как механическую, так и немеханическую виды работ.
Термодинамическая система называется закрытой, если она не обменивается с окружающей средой веществом.
Термодинамическая система называется открытой, если она обменивается с окружающей средой веществом.
Термодинамическая система, абсолютно не взаимодействующая с окружающей средой, называется изолированной. Термодинамическая система называется адиабатной, то есть термоизолированной, если она не обменивается с окружающей средой теплотой.
При взаимодействии с окружающей средой рабочее тело переходит из одного состояния в другое, о чем можно судить по изменению параметров, поддающихся прямому измерению.
Физические величины, характеризующие систему в состоянии равновесия, называют параметрами состояния. Они относятся к системе в целом и не зависят от вида процесса.
Если параметры рабочего тела сохраняют постоянные значения, и равны соответствующим параметрам окружающей среды, то такое состояние термодинамической системы называют равновесным. В противном случае состояние рабочего тела называют неравновесным.
Параметрами состояния рабочего тела являются удельный объем, давление, температура.
Удельный объем – это объем, занимаемый одним килограммом рабочего тела. Он равен отношению объема газа V к его массе M:
v = 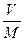 , м
, м  / кг (1.1)
/ кг (1.1)
Удельный объем является величиной, обратной плотности ρ:
v = 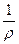 (1.2)
(1.2)
В случае замкнутой системы изменение удельного объема обусловлено только изменением ее объема. При этом, если удельный объем уменьшается, то система подвергается сжатию. Если удельный объем увеличивается, то система расширяется.
Абсолютное давление Р – сила, действующая на единицу поверхности рабочего тела:
1 Н/м 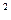 = 1 Па
= 1 Па
Давление газов обусловлено ударами молекул о стенки резервуара.
Абсолютная температура – это величина, пропорциональная средней кинетической энергии частиц (молекул газа), из которых состоит система.
Единицей измерения температуры является Кельвин (К) или градус Цельсия (0°С).
Термодинамическая температурная шкала установлена по температуре, при которой лед, вода и пар находятся в равновесии друг с другом. Ей соответствует температура, равная 273, 16 К и 0, 01°С. Один градус Кельвина равен одному градусу Цельсия, и температура Т, выраженная в Кельвинах, связана с t, выраженной в Цельсиях, соотношением:
Т = t + 273, 15 К (1.3)
Температура тела характеризует его способность к теплообмену с окружающей средой или другими телами, включенными в рассматриваемую систему. Теплообмен возможен только при наличии хотя бы бесконечно малой разности температур. Это означает, что температура позволяет судить о наличии или отсутствии теплового равновесия между телами, находящимся в тепловом контакте друг с другом.
Термодинамический процесс – это последовательное изменение равновесных состояний рабочего тела.
Если в результате прямого и обратного процессов рабочее тело возвращается в исходное состояние и при этом не изменяет окружающую среду, то такой процесс называется обратимым.
Если при прямом и обратном процессах рабочее тело возвращается в исходное состояние, но при этом отдает часть теплоты окружающей среде, то такой процесс является необратимым.
Все действительные процессы в земных условиях являются необратимыми. Однако, при изучении элементарных термодинамических процессов, они рассматриваются как обратимые процессы, в которых теплота и работа преобразуются в эквивалентных количествах.
1 .2 Уравнение состояния идеального газа.
Параметры состояния равновесной термодинамической системы связаны между собой зависимостью, называемой уравнением состояния.
В термодинамике пользуются уравнениями состояния, полученными из опыта или найденными методами статистической физики. В основном это дифференциальные уравнения.
Использование понятия идеального газа позволяет получать термодинамические соотношения в наиболее простой форме.
Для 1 кг идеального газа уравнение состояния идеального газа имеет вид: 
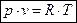 , (1.4)
, (1.4)
где P – абсолютное давление, Н/м2 ;
v– удельный объем, м3/кг;
T – абсолютная температура, К;
R – удельная газовая постоянная, [Дж/кг*К].
Удельная газовая постоянная показывает, какую работу нужно совершить, чтобы изменить температуру 1 кг газа на 1 К, в изобарном процессе (Р = const).
Для произвольной массы газа М, пользуются уравнением состояния идеального газа в виде:
pּ V = Mּ Rּ T, (1.5)
где V – полный объем газа, м3;
М – масса газа, кг.
Величина удельной газовой постоянной, входящей в уравнения (1.4), (1.5) зависит от молярной массы газа μ, кг/моль, и определяется по формуле:
R = 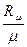 , (1.6)
, (1.6)
где Rμ – универсальная газовая постоянная; Rμ = 8, 314ּ 103 [Дж/моль*К]
Уравнение состояния идеального газа применимо для описания поведения реальных газов при их сравнительно малых плотностях. Если это условие не соблюдается, то возникает проблема учета конечного объема молекул и межмолекулярных сил.
Простое уравнение состояния для неидеальных газов было предложено в 1873 г. Ван-дер-Ваальсом:
(Р +  )ּ (V – b) = Rּ T, (1.7)
)ּ (V – b) = Rּ T, (1.7)
где a – величина, зависящая от сил взаимодействия между молекулами данного газа;
b – величина, учитывающая собственный объем молекул и силы отталкивания, возникающие между ними.