
Главная страница Случайная страница
КАТЕГОРИИ:
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Гострі лейкемії.
|
|
В основі клінічних проявів гострих лейкемій лежать анемічний, гіперпластичний, геморагічний, імунодефіцитний, виразково-некротичний синдроми.
Класифікація гострих лейкемій традиційно основана на морфологічних та цитохімічних характеристиках. Однак останні досягнення в імунології, молекулярній біології, цитогенетиці значною мірою підвищили наше розуміння біологічних маркерів, які допомагають відрізнити нормальнігемопоетичні клітини від їх лейкозних аналогів. Такі технології надзвичайно просунули наші уявлення про диференціювання лейкоцитів і клітинне походження гострих лейкемій. Окрім того, ці технології більш точно класифікували злоякісний клон у більшості випадків як мієлоїдний, В-, Т-лімфоїдний, або біфенотиповий.
Досягнення у цитогенетиці збільшили наше розуміння про зв’язок певних хромосомних аномалій їз специфічними морфологічними підтипами гострих лейкемій і дали підтвердження того, що генетичні зміни відіграють основну роль у трансформації нормальних клітин на злоякісні. Ідентифікована ціла низка хромосомних змін, які мають важливе прогностичне значення щодо реакції на хіміотерапію, так і на загальне виживання.
Традиційна класифікація гострих лейкемій пов’язана з морфологічним описом клітин, що домінували у популяції кісткового мозку і зіставлялися з нормальними аналогами. Назва форм гострої лейкемії походить від назв нормальних попередників пухлинних клітин мієлобластів, лімфобластів, еритробластів та ін. У 1976 р. гематологи Франції, США, Великобританії розробили класифікацію гострих лейкемій (FAB), основану на морфологічних ознаках клітин, а пізніше, у 1980 р. було внесено деякі уточнення та нові діагностичні методики.
Гостра лімфобластна лейкемія (ГЛЛ). FAB-класифікаційна система описує 3 підтипи ГЛЛ (L1, L2, L3), які визначаються за індивідуальними цитологічними ознаками, такими як розмір клітин, характер ядерного хроматину, форма ядра, ядерець та інтенсивність базофілії цитоплазми.
Підтип L1 становить понад 80 % усіх випадків ГЛЛ у дітей і близько 30 % у дорослих. Складається з малих лімфоцитів. Ядерця часто не візуалізуються. Цитоплазма дуже мала і звичайно помірно базофільна.
Більшість випадків ГЛЛ у дорослих спричиняє підтип L2. Ці клітини більші, ніж L1, і часто гетерогенні за розміром. Форма ядра також неправильна, ядерця чіткіше виражені, ніж ядерця підтипу L1. Кількість цитоплазми та її базофілія варіюють.
L3 підтип ГЛЛ зустрічається у 3-4 % дітей та дорослих. Цей підтип за морфологічними ознаками ідентичний пухлинним клітинам злоякісної лімфоми Беркіта. Клітини досить великих розмірів, мономорфні, з ніжною структурою хроматину і правильною формою ядра. Ядерця чітко виражені. Цитоплазма помірно широка, базофільна. Розмір клітин вважають має значення тільки тоді, коли понад 50 % бластів є великими. Цитохімічна оцінка бластних клітин при ГЛЛ має характерні ознаки (табл. 64). Реакція на мієлопероксидазу та ліпіди (із суданом чорним В) негативна. PAS-реакція в лімфобластах підтипів L1 і L2 позитивна.
Гостра мієлобластна лейкемія (ГМЛ). Бластні клітини хворих на ГМЛ більших розмірів, ніж лімфобласти, та відрізняються більшою гетерогенністю щодо розміру та форми. Цитоплазма при ГМЛ велика, містить цитоплазматичні гранули: азурофільні, аномальні лізосомальні гранули, палички Ауера. Діагноз ГМЛ встановлюється, коли понад 30 % усіх ядровмісних клітин кісткового мозку є бластними клітинами. Згідно з FAB-класифікацією визначають 8 варіантів ГМЛ, які включають 3 типи М1, М2, М3 з переважно гранулоцитарним диференціюванням, 2 типи (М4, М5), що мають моноцитарних попередників, і тип М6 з високим вмістом еритробластів. М7 - мегакаріобластний варіант, який дуже рідко зустрічається.
Окрім того, FAB-група описала форму ГМЛ з мінімальною мієлоїдною диференціацією - М0, яка не може бути визначена тільки на морфологічній та цитохімічній основі, а потребує імуногістохімічного фарбування. Ці клітини не фарбуються на мієлопероксидазу, але експресують мієлоїдні антигени на поверхні бластних клітин.
| Таблиця 64. | ||||||||
| Основні цитохімічні характеристики бластних клітин при гострих лейкеміях. | ||||||||
| Форми гострих лейкемій | Полісаха-риди | β -глюкоро-нідаза | Фосфо-ліпіди | Перокси-даза | Хлорацетат- естераза | Неспеци-фічна естараза | Кислі сульфато-вані мукополі-сахариди | |
| Мієлобластний | - | - | + | + | + | - | - | |
| Мієломонобластний | - | - | + | + | + | + | - | |
| Монобластний | - | - | - | - | - | + | - | |
| Промієлоцитарний | + | + | + | + | + | + | + | |
| Еритробластний | + | - | - | - | - | - | - | |
| Лімфобластний | + | + | - | - | - | - | - | |
| Недиференційований | - | - | - | - | - | - | - | |
Імунобіологія гострої лейкемії. Близько 80 % захворювань на ГЛЛ виникає з клітин В-ряду. У більшості випадків клітини експресують антигени ГЛЛ “загального типу” або CALLA, визначений як CD10. Такі клітини експресують також інші В-клітинні диференційовані антигени CD19 і CD20. У них також відбувається реаранжування важких і/ або/ легких ланцюгів імуноглобулінів (Ig).
CD10-несучі клітини поділяють на основі навності IgG. У більшості випадків клітини не експресують IgG і в таких випадках діагноз виглядає так: “Гостра лейкемія з ранніх В-клітин-попередників”. У 20 % хворих експресують IgG Експресія поверхневих Ig (sIg) спостерігається тільки у 2-5 % випадків гострої лімфобластної лейкемії.
Від 15 до 20 % гостра лімфобластна лейкемія виникає з Т-клітин, які експресують Т-клітинні антигени CD5 і CD7.
Подальше субкласифікування Т-гострої лімфобластної лейкемії на типи з ранніх, проміжних або зрілих тимоцитів основане на експресії різних Т-клітинних диференційованих антигенів. Дуже невелика частка гострих лімфобластних лейкемій не має ознак В- /або Т-клітин. В такому разі у діагнозі вказують “нуль-клітинна гостра лімфобластна лейкемія.
Гостра мієлобластна лейкемія досі в імунологічному відношенні не ідентифікована.
Згідно класифікації, запропонованою Європейською групою з урахуванням імунофенотипування, гострі лейкемії поділяють на 4 групи: гостра лімфобластна лейкемія, гостра мієлобластна лейкемія, біфенотипічні гострі лейкемії та недиференційовані гострі лейкемії:
1. Гострі лімфобластні лейкемії:
В-лінійні;
Т- лінійні
З експресією одного або двох мієлоїдних маркерів
2. Гострі мієлоїдні лейкемії: мієломоноцитарна, еритроїдна, мегакаріоцитарна, низькодиференційована мієлоїдна та з експресією одного або двох лімфоїдних маркерів.
3. Біфенотипічні гострі лейкемії.
4. Недиференційовані гострі лейкемії.
Цитогенетика гострої лейкемії. При гострій лейкемії відбуваються цитогенетичні аномалії. Цитогенетичний аналіз дав багато важливого для субкласифікування гострих лейкемій. Ретельний аналіз дозволив ідентифікувати низку генів, яківідіграють іентегральну роль у лейкемієгенезі. І хоча тепер ще досить маловідомо про функції цих онкогенів, є думка, що вони приймають участь у контролі клітинної проліферації і диференціюванні. Структурні зміни хромосом можуть призвести до активації онкогенів і порушення клітинного регулювання і, відповідно, до злоякісної трансформації.
Клінічні особливості перебігу гострих мієлоїдних лейкемій.
Середній вік хворих приблизно становить 60 років. Чоловіки й жінки хворіють однаково часто. Приблизно в 1/3 хворих спостерігається виражений геморагічний синдром. У 25 % хворих приєднуються інфекційні ускладнення. Для 50 % хворих на монобластну лейкемію характерні лімфаденопатія, гіпертрофія ясен і інфільтрація бластами шкіри (leukemia cutis). Сплено- і гепатомегалія виявляються менш ніж у 25 % хворих.
При гострій мієлобластній лейкемії інфільтрація бластами не обмежується кістковим мозком, а може спостерігатися в будь-яких органах і спричиняти метаболічні ускладнення, обумовлені лейкозним процесом. Можуть розвиватися солідні пухлини, так звані гранулоцитарні саркоми. Найчастіше поражуються шкіра, кістки, особливо грудина, ребра, орбіта, але гранулоцитарні саркоми можуть локалізуватися і в будь-яких інших органах.
Порушення дихання у хворих на гостру мієлобластну лейкемію часто пов’язане з інфекцією. У хворих з високою кількістю циркулюючих бластних клітин в гемоциркуляції (> 100 000/ml) можуть розвиватися виражене диспное і гіпоксемія, які пояснюються лейкостазом у капілярах легень. Різні дисфункції серця обумовлені анемією. Геморагії на сітківці ока часто розвиваються внаслідок тромбоцитопенії.
Залучення у пухлинний процес ЦНС при гострій мієлобластній лейкемії майже не спостерігаються.
Кількість лейкоцитів підвищена в 1/3 хворих, але останнім часом лейкоцитоз понад 100 000 в 1 мл спостерігається менше ніж у 10 % хворих, що можна пояснити ранньою діагностикою гострих лейкемії. У периферійній крові може бути вивлена деяка кількість бластів. Абсолютна кількість гранулоцитів практично завжди знижена і у 50 % хворих складає менше ніж 1500 в 1 мл. Частою є помірна анемія, кількість тромбоцитів менше ніж 100 000 в 1 мл, у багатьох хворих - менше ніж 20 000 в 1 мл. Характерним є деяке підвищення рівня сечової кислоти у сироватці крові, може бути підвищеним рівень ЛДГ.
Клінічні особливості перебігу гострої лімфобластної лейкемії. Гостра лімфобластна лейкемія складає у дорослих приблизно 20 %. Клінічні ознаки (слабкість, втрата маси тіла, лихоманка, нічні потіння) зазвичай з’являються за декілька тижнів до встановлення діагнозу, але можуть бути і не дуже вираженими. Біль у кістках і суглобах спостерігається частіше у дітей. Інфекції і геморагічний синдром спостерігається у третини хворих. Збільшення лімфатичних вузлів, спленомегалія та гепатомегалія зустрічаються частіше, ніж при гострій мієлобластній лейкемії.
Рентгенографія грудної клітки виявляє розширення середостіння у 15 % хворих. Залучення у лейкозний процес ЦНС спостерігається у 5-10 % хворих. Найчастіше в процес залучаються VI і VII пари черепно-мозкових нервів. Головний біль, нудота, блювання спостерігаються внаслідок інфільтрації твердої мозкової оболонки бластами. При цьому порушується відтік рідини з підвищенням внутрішньочерепного тиску.
Кількість лейкоцитів знижена у третини хворих, нормальна або помірно підвищена в половини хворих на гостру лімфобластну лейкемію, і лише в 16 % може бути значний лейкоцитоз (> 100 000 в 1 мл) в момент встановлення діагноза.
Ступінь нейтропенії, анемії, тромбоцитопенії варіює. Типовою є помірна анемія з рівнем Hb менше ніж 80 г/л. Часто (майже у 50 % хворих) спостерігається тромбоцитопенія менше ніж 50 000 в 1 мл. ШОЕ при гострій лейкемії нерідко значно збільшена, але може бути й нормальною.
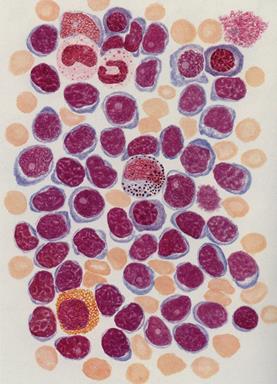
| Рис. Тотальна лімфатична метаплазія кісткового мозку при хронічній лімфоїдній лейкемії (адаптовано за М.Г.Абрамовим, 1985). |
Класифікація гострої лейкемії за стадіями.
· Початкова - до цього часу визначити конкретно її не вдається.
· Розгорнутий період захворювання характеризується значним пригніченням нормального кровотворення, високим бластозом у кісткового мозку.
· Повна ремісія - це стан, за якого в пунктаті кісткового мозку знаходять не більше 5 % бластних клітин і загальна кількість лімфоїдних клітин складає менше ніж 40 %. Екстрамедулярні лейкемічні проліферати відсутні.
· Одужанням від гострої лейкозу вважається повна ремісія протягом 5 років (безрецидивне 5-річне виживання).
· Рецидив гострої лейкемії може бути кістковомозковим або місцевим.
· Термінальна стадія - поняття умовне, відображає сучасні терапевтичні можливості і інкурабельний стан пухлинної прогресії.
Лікування гострої лімфобластної лейкемії. Лікування складається з індукції ремісії, консолідації (закріплення) ремісії та підтримуючої терапії. Крім того, проводиться профілактика нейролейкемії впродовж усього часу індукції ремісії, консолідації та періоду ремісії.
Для індукції ремісії використовують схеми поліхіміотерапії, що складені за гістогенезом пухлинної клітини та фази клітинного циклу.
Основними препаратами є вінкристин, L-аспарагіназа, даунорубіцин, циклофосфан, цитозар, 6-меркаптопурин, тіогуанін у різних комбінаціях.
Зараз оптимальною стандартизованою терапією вважається програма (4-6-тижнева схема), що містить 3 препарати: вінкристин, преднізолон і один із протипухлинних антибіотиків (рубоміцин, даунорубіцин, адріабластин). Ефективність цієї програми підтверджується насамперед найвищими показниками повних ремісій та виживання хворих.
Останнім часом отримала значного поширення так звана протокольна терапія ГЛЛ. Частіше застосовують Hoelzer-Protocol (1992). Окрім цього, застосовують інші схеми - ВАМП, ЦВАМП, ЦОАП, ПОМП, СЦАМП, ЦЛАП. Їх треба розглядати як програми 1-го покоління, що мають в основному історичний інтерес, оскільки вони розроблялися та використовувалися в 60-70-х роках. З певним обмеженням тепер їх використовують у разі рефрактерності до стандартизованих програм, у хворих похилого віку, а також за навності тяжких захворювань, які обтяжують перебіг гострої лейкемії.
Профілактика нейролейкемії проводиться за загальними правилами. Наступного дня після діагностичної стернальної пункції проводять діагностичну спинномозкову пункцію з уведенням метотрексату 12 мг/м2 (але не більше, ніж 15 мг). У подальшому ендолюмбальне уведення метотрексату проводять що 2 тижні в період індукції та курсу консолідації.
Продовжують профілактику нейролейкемії з 1-го тижня ремісії за цитологічно нормального складу спинномозкової рідини (цитоз менше ніж 10 в 1 мкл) і відсутності бластних клітин.
Опромінювання голови у сумарній дозі 24 Гр проводять протягом 2, 5-3 тижнів по 1, 5 Гр на сеанс, із двох латеральних полів. Інтралюмбально, починаючи з 3-го дня опромінювання, вводять МТХ по 12, 5 мг/м2, 5 уведень (по 2 на тиждень).
Лікування нелімфобластної (мієлоєдної) лейкемії. Для індукції ремісії використовують такі схеми поліхіміотерапії, як “7+3”, “5+2”, “TAD-9”, HAM тощо, складовими частинами яких є цитозар, рубоміцин (карміноміцин), даунорубіцин, тіогуанін, амсакрин, мітоксантрон, високі дози циклофосфаміду та цитозару.
Для досягнення повної ремісії необхідно провести від 2 до 4-5 курсів поліхіміотерапії. Консолідація проводиться, як правило, за тими ж схемами. Кількість консолідуючих курсів може бути 2-3. Кількість днів між курсами індукції та консолідації ремісії визначається часом відновлення гранулоцитів, тромбоцитів (до 1, 0 × 109/л гранулоцитів і 100 × 109/л тромбоцитів).
Підтримуюча терапія призначається через 7-10 днів після закінчення курсу консолідації. Лікування під час ремісії проводять щомісячно, призначаючи поліхіміотерапію курсами.
Схеми поліхіміотерапії з високими дозами цитозара: по 3 г/м2 що 12 год, протягом 4-6 діб у вигляді монотерапії або у поєднанні з L-аспарагіназою 6000- ОД/м2, антрациклінами чи амсакріном при резистентних формах та рецидивах захворювання.
При резистентних формах можна застосовувати також мітоксантрон (препарат антрахінонового ряду) в дозі 10-12 мг/м2 на добу, протягом 5 діб у поєднанні з цитозаром. Етопозид, теніпозид, особливо в комбінації з цитарабіном, рубоміцином, ломустином, амсакрином та високими дозами метотрексату, дають позитивний ефект при рецидивних та рефрактерних формах гострої мієлобластної лейкемії.
На жаль, усі описані програми для лікування гострої мієлобластної лейкемії, особливо застосування високих доз цитостатиків, спричиняють багато ускладнень, а ремісії, індуковані ними, залишаються короткими (більше ніж рік лише у 10 % хворих). Альтернативним та перспективним варіантом вважається аллогенна або аутологічна трансплантація кісткового мозку та периферичних стовбурових клітин. Велике значення для успішного лікування гострої лейкемії, особливо гострої мієлобластної лейкемії, має симптоматична (супроводжувальна) терапія або така, що спрямована на профілактику, лікування інфекційних ускладнень, інтоксикаційного та геморагічного синдромів.
Для профілактики інфекційних ускладнень, а також під час агранулоцитозу після інтенсивного лікування проводиться антибактеріальна терапія в асептичних умовах (у боксі на одне місце) за допомогою антибіотиків широкого спектра дії. У разі загрози розвитку інвазивного мікозу, особливо, спричиненого грибами роду Candida, необхідно підключити міконазол. За наявності системної грибкової інфекції показане лікування амфотерицином В. Проводиться профілактика та лікування вірусних інфекцій. При Herpes simplex, Herpes Zoster показаний ацикловір або його аналоги. При цитомегаловірусних інфекціях (ЦМВ-пневмонія, ЦМВ-гепатит) показані ганцикловір, цимевен або фоскарнет у комбінації з гіперімунним глобуліном (анти-ЦМВ) або зовіракс. Для профілактики гострого синдрому клітинного лізису призначають алопуринол у дозі 10 мг/кг/добу протягом 3-8 днів, гідратацію 3 000-5 000 мл/м2 протягом 24 год.(5 % розчин глюкози з ізотонічним розчином натрію хлориду).
З метою олужнення сечі застосовують гідрокарбонат натрію, під контролем pH сечі. Ідеальним pH сечі є 7, 0.
Заміщення дефіциту еритроцитів проводять у тому разі, якщо Hb є менше 70 г/л, але не при гіперлейкоцитозі; заміщення дефіциту тромбоцитів проводять якщо їх рівень становить менше ніж 70 000 мм3. При зниженні дози фібриногена крові нижче 2 000 мг/л застосовується свіжозаморожена плазма - до 30 мл/кг/добу в 3 прийоми.