
Главная страница Случайная страница
КАТЕГОРИИ:
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Уравнение изотермы химической реакции
|
|
При протекании химической реакции через некоторое время устанавливается равновесное состояние, когда скорости прямой и обратной реакции равны. Пусть в смеси идеальных газов протекает химическая реакция:
аА + вВ = eЕ + lL,
где а, в, е и l – число моль газообразных веществ А, В, Е и L, принимающих участие в реакции или стехиометрические коэффициенты.
Пусть в реакцию вступило бесконечно малое количество вещества А (dnA); с ним прореагировало бесконечно малое количество вещества В (dnB). В результате реакции образовалось dnE и dnL моль веществ С и D. Так как количество исходных веществ в ходе реакции убывает, а продуктов увеличивается, то величины dnA и dnB отрицательны, а dnE и dnL – положительны. Тогда изменение энергии Гиббса при протекании указанного процесса равно
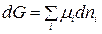

Выразим количества моль прореагировавших веществ dnA, dnB, dnE, и dnL через стехиометрические коэффициенты уравнения реакции. Согласно уравнению реакции:
с а моль вещества А реагирует в моль вещества В
с dnA моль dnB,
тогда
 .
.
Аналогично можно выразить:
 ;
;

Подставим в уравнение для dG:
 .
.
Умножим левую и правую часть уравнения на а и поделим на dnA:

Так как химический потенциал равен мольной энергии Гиббса  , то
, то
 ,
,
следовательно,

Химический потенциал компонента реакционной смеси равен
 .
.
Подставим в уравнение

Обозначим сумму
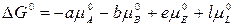 ,
,
Тогда
 . (3.1)
. (3.1)
где Δ G0 – изменение энергии Гиббса в стандартных условиях; pE, pL, pA, pB – рабочие (неравновесные) парциальные давления компонентов в реакционной смеси.
Уравнение (3.1) называется уравнением изотермы химической реакции,
При постоянных давлении и температуре общим условием термодинамического равновесия является Δ G = 0. Тогда парциальные давления компонентов становятся равновесными  и из уравнения (3.1) следует, что
и из уравнения (3.1) следует, что
 .
.
Введем обозначение:
 , (3.2)
, (3.2)
где Кр – термодинамическая константа равновесия – величина постоянная для данной реакции при данной температуре.
Термодинамическая константа равновесия является безразмерной величиной.
Полученное уравнение (3.2) выражает известный закон действия масс: отношение произведения равновесных парциальных давлений продуктов реакции, взятых в степенях, равных стехиометрическим коэффициентам к аналогичному произведению для исходных веществ при данной температуре есть величина постоянная.
С учетом Кр получим
 ,
,
тогда константу равновесия реакции можно рассчитать по уравнению:
 .
.
Кр не зависит от давления, так как связана с изменением энергии Гиббса в стандартных условиях, т.е. при р = 1 атм.
Закон действия масс можно выразить не только через парциальные давления реагирующих веществ, но и через молярные концентрации (Кс) и мольные доли (Кх). Парциальное давление компонента системы связано с его молярной концентрацией и мольной долей уравнениями:
 ,
,
где xi – мольная доля i -го участника реакции; pобщ – общее давление реакционной смеси; сi – молярная концентрация i -го участника реакции.
Тогда
 ;
;

Константы Кх связаны Кр соотношением
 ,
,
где 
Аналогично

Константа Kx зависит от общего давления реакционной смеси.
Если реакция протекает в реальной системе, то вместо концентраций следует применять активности реагентов ai, а вместо парциальных давлений – фугитивности:
 ;
;
 ,
,
где  - активность i-го участника реакции;
- активность i-го участника реакции;
γ i – коэффициент активности;
 - фугитивность (летучесть) i-го участника реакции;
- фугитивность (летучесть) i-го участника реакции;
γ fi – коэффициент летучести.
Если химическая реакция протекает с участием конденсированных веществ (твердых или жидких), то химический потенциал таких веществ зависит только от температуры и при Т = const является постоянной величиной. Поэтому парциальные давления конденсированных веществ постоянны и входят в значение Кр, а закон действия масс записывается только для газообразных участников реакции. Например, для реакции
СаСО3(тв) = СаО(тв) + СО2(г)
закон действия масс имеет вид
 .
.
Значения констант равновесия многих химических реакций при 298 К приведены в справочной литературе.