
Главная страница
Случайная страница
КАТЕГОРИИ:
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
|
II. Молекулярная физика и термодинамика.
II.1. В ходе изобарического нагревания при давлении p газ совер-шил работу A = p (V − V), где 1– объем газа в конце нагревания. В

соответствии с первым началом термодинамики, Q = A + ∆ U 2= A + Q 2, где ∆ U = Q 2 – изменение внутренней энергии газа при изохорическом нагревании. Следовательно, Q − Q 2= A = p (V − V), откуда V = V + 1 pQ 2. Применим к процессу изобарического нагревания газа
 
закон Гей-Люссака: T = T, где T и T – абсолютные температуры
газа в начале и в конце нагревания. Отсюда, с учетом выражения для объема V, получаем ответ:

T = æ 1+ Q − Q 2 T = 400 К, то есть t» T − 273 =127 °C.
è ø
Решения задач
 
II.2. В соответствии с определением, КПД цикла h = A, где A –
работа, совершенная гелием за один цикл, а Q – количество теплоты,
полученное гелием за цикл. Указанную работу можно найти, вычислив площадь фигуры, ограниченной графиком цикла на приведенной в ус-ловии задачи pV –диаграмме:
A = 3 p V.
 
Гелий получает от нагревателя теплоту на участках 1, 4 и 6. Молярные теплоемкости гелия при изобарическом и изохорическом нагревании равны Cp = 5 R и C = 3 R соответственно, где R – универсальная
газовая постоянная. Поэтому для количеств теплоты, получаемых газом на указанных участках, можно записать:
Q = 5 R ∆ T /2, Q 4 = 3n R ∆ T /2 и Q = 3 R ∆ T /2.
С помощью уравнения Менделеева–Клапейрона pV = n RT, применен-
ного к процессам 1, 4 и 6, выражения для количеств теплоты можно представить в виде:
Q = (5/2)× 3 p 0 × 2 V =15 p V; Q 4 = (3/2)× p 0 × 2 V 0 = 3 p V; Q = (3/2)× p 0 × V 0 = 3 p V 0 /2.

Следовательно, Q = Q + Q 4+ Q 6= 39 p V 0. С учетом этого получаем

ответ: h = 13» 0, 154, то есть h» 15, 4%.
II.3. На участке 1 − 2 газ получил от нагревателя количество тепло-ты, равное приращению его внутренней энергии, ∆ Q 2= ∆ U 12= 4 кДж. Следовательно, процесс 1 − 2 – изохорный. На участке 2 − 3 газ не об-менивался теплотой с окружающими телами, то есть данный процесс – адиабатный. На участке 3 − 1 внутренняя энергия газа оставалась неиз-
Физический факультет
  
менной, то есть это изотермический процесс. На участке 3 − 1 газ отдал количество теплоты, модуль которого равен ∆ Q 31= 3 кДж. По опреде-лению, КПД цикла h =1− ∆ Q 31= 1, то есть = 25%.
II.4. Давление p н = p 0 +(Mg S).
насыщенных паров жидкости в цилиндре равно В соответствии с уравнением Менделеева–
Клапейрона, плотность насыщенных паров при температуре равна
 
rн = RT, где R – универсальная газовая постоянная. Так как нагрева-ние осуществлялось медленно, то температура жидкости оставалась неизменной, давление насыщенных паров также не изменялось, а вся сообщаемая системе теплота расходовалась на испарение жидкости при данной температуре. Поэтому масса испарившейся жидкости ∆ m = Q.
С другой стороны, эта масса может быть выражена через искомую вы-соту поднятия поршня: ∆ m = н S ∆ h. Объединяя все записанные выра-жения, получаем:
Q QRT QRT
   r rн S r µ Sp н (Mg + p 0 S) r µ r rн S r µ Sp н (Mg + p 0 S) r µ
II.5. Будем считать, что газ и пар подчиняются уравнению Менде-леева–Клапейрона. Тогда плотности газа и пара rги rпсвязаны с их парциальными давлениями p г и p п следующими соотношениями:
 
rг = p г T г и rп= p пµп,
где R – универсальная газовая постоянная, T – абсолютная температу-ра. Из закона Дальтона для смеси газа и пара следует, что давление в сосуде равно сумме парциальных давлений газа и пара: p = p г+ p п. В соответствии с определением относительной влажности, р п= f p н. Объединяя записанные выражения, найдем искомое отношение:
Решения задач
   
n =rг = p гµг =(p − fp н)µг. п п п н п
|











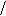







 r rн S r µ Sp н (Mg + p 0 S) r µ
r rн S r µ Sp н (Mg + p 0 S) r µ




