
Главная страница Случайная страница
КАТЕГОРИИ:
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Вода у харчових системах
|
|
Вода не є поживною речовиною, але вона життєво необхідна, як стабілізатор температури тіла, переносник нутрієнтів (поживних речовин) і травних відходів, реагент і реакційне середовище в ряді хімічних перетворень. Крім того, вода формує органолептичні показники продукту.
Вміст вологи (%) у харчових продуктах змінюється в широких межах: від 5 – 15% в борошні, сухому молоці, маслі, маргарині до 85 – 95% у молоці, фруктах, овочах, пиві, соках.
На відміну від інших речовин, вода характеризується рядом аномалій. Для неї характерні висока температура кипіння 100°C і плавлення 0°C, високі значення теплоти фазових переходів (плавлення 6, 01 кДж/моль, пароутворення 40, 63 кДж / моль, сублімації 50, 91 кДж / моль). Крім того, вода має аномально високу теплоємність і, таким чином, є регулятором температури в живих організмах і в цілому на земній кулі. Вода розширюється при замерзанні, внаслідок чого щільність льоду нижче, ніж води.
Вода при атмосферному тиску може існувати в станах рідини, пари та льоду.
Аномальні властивості води визначаються її структурою. Так в молекулі води шість валентних електронів Оксигену гібридизовані в чотирьох sр3 – орбіталях, які витягнуті до кутів, утворюючи тетраедр. Дві гібридні орбіталі утворюють О–Н ковалентні зв'язки, тоді як інші дві орбіталі мають неподілені електронні пари. Ковалентні О–Н зв'язки, завдяки високій електронегативності атома Оксигену, частково мають іонний характер. Таким чином, молекула води має два негативних і два позитивних заряди по кутах тетраедра, тобто має дипольну структуру. Внаслідок цього, кожна молекула води координована з чотирма іншими молекулами води завдяки водневим зв'язкам, що забезпечує більшу силу взаємодії між молекулами і пояснює особливі фізичні властивості води.
З хімічної точки зору вода є досить реакційноздатною речовиною. Вона реагує з багатьма оксидами металів і неметалів, взаємодіє з активними металами, бере участь в реакціях перетворення білків, ліпідів, вуглеводів.
При додаванні різних речовин до води змінюються властивості як самої речовини, так і води. З зарядженими іонами металів і кислот вода утворює міцні іонні зв'язки. З нейтральними, але полярними молекулами (спирти, аміни, альдегіди, кетони) вода утворює водневі зв'язками (більш слабкі, ніж іонні зв'язки). З неполярними речовинами (вуглеводні) вода хімічно не взаємодіє, але утворює навколо них сітку з молекул води.
1.2.1. Вільна та зв’язана волога
У харчових продуктах волога може бути вільною або зв'язаною.
У забезпеченні стійкості продукту при зберіганні важливу роль відіграє співвідношення вільної та зв'язаної вологи.
Вільна волога – це вода, що не зв'язана з полімерами, і доступна для протікання біохімічних, хімічних і мікробіологічних реакцій. Зв'язана волога – це асоційована вода, міцно пов'язана з різними компонентами – білками, ліпідами і вуглеводами за рахунок хімічних і фізичних зв'язків. Для зв'язаної води характерні наступні властивості:
- існує поблизу розчиненої речовини та інших наведених речовин і має властивості, відмінні від властивостей вільної води;
- не може служити розчинником для доданих речовин;
- не замерзає при низьких температурах (-40°С і нижче).
«Зв'язування води» і «гідратація» – це здатність води до асоціації з гідрофільними речовинами різного ступеня міцності. Розмір і сила зв'язування води або гідратації залежить від таких факторів як природа неводного компонента, його сольовий склад, рН, температура. Найбільш міцно зв'язаною є так звана органічно зв'язана вода. Вона являє собою дуже малу частину води в високовологих харчових продуктах і знаходиться, наприклад, в щілинних областях білка або у складі хімічних гідратів. Іншою дуже міцно зв'язаною водою є прилегла волога, що представляє собою моношар при більшості гідрофільних груп неводного компонента. До моношару прилягає багатошарова вода (вода полімолекулярної адсорбції), що утворює декілька шарів за прилеглою водою. Багатошарова вода – ще менш міцно пов'язана волога.
У харчових продуктах є також вода, яка утримується макромолекулярною матрицею. Наприклад, гелі пектину і крохмалю, рослинні і тваринні тканини при невеликій кількості органічного матеріалу можуть фізично утримувати великі кількості води. Ця вода не виділяється з харчового продукту навіть при великому механічному зусиллі. З іншого боку, в технологічних процесах обробки вона веде себе майже як чиста вода. Її, наприклад, можна видалити при висушуванні або перетворити на лід при заморожуванні.
1.2.2. Активність води
З світової практики відомо, що існує взаємозв'язок між вмістом вологи харчових продуктів та їх збереженням (або псуванням). Однак, часто різні харчові продукти з одним і тим же вмістом вологи псуються по-різному, що можна пояснити різним співвідношенням «вільної» і «зв'язаної» вологи. Щоб врахувати ці фактори, було введено термін «активність води». Цей показник добре корелюється зі швидкістю багатьох руйнівних реакцій.
Активність води (aw) – це відношення тиску парів води над даним продуктом до тиску парів над чистою водою за тих же умов. За величиною активності води виділяють: продукти з високою вологістю (aw= 0, 9 – 1, 0) (фрукти, овочі, молоко й рідкі молочні продукти, варені ковбаси); продукти з проміжною вологістю (aw= 0, 6 – 0, 9) (сири, хлібобулочні вироби, в'ялені м'ясні вироби); продукти з низькою вологістю (aw=0, 0 – 0, 6) (молоко сухе, борошно, злакові й круп'яні).
Залежність між вмістом вологи (маса води, гН2О/гСВ) в харчовому продукті і активністю води в ньому при постійній температурі, називається ізотермою сорбції (рис. 2). Очевидно, що в продуктах з високим вмістом вологи «активність води» вища, ніж в продуктах з низьким вмістом вологи.
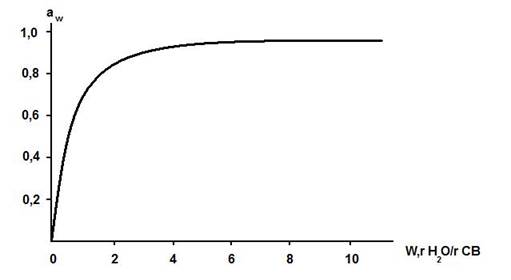
Рис. 2. Ізотерма сорбції вологи для продуктів з високою вологістю
Встановлено, що в продуктах з низькою вологістю при зберіганні можуть відбуватися процеси окислення жирів, неферментативне потемніння, втрата водорозчинних речовин (вітамінів), псування, викликане ферментами. Роль мікроорганізмів тут мінімальна. У продуктах з проміжною вологістю можуть протікати різні процеси, в тому числі значно зростає роль мікроорганізмів у псуванні. У процесах, що протікають при високій вологості, мікроорганізмам належить вирішальна роль. При цьому дріжджі та цвілі менш чутливі до низького вмісту вологи. Для них сприятливе середовище, якщо в ньому активність води вища за 0, 6. Для бактерій і цвілі граничне значення активності води не повинно бути нижчим за 0, 9. В цілому процеси псування значно сповільнюються при значеннях аw= 0, 2 – 0, 4. Для зниження активності води використовують такі технологічні прийоми, як сушіння, в'ялення, додавання різних речовин (цукор, сіль тощо), заморожування.
1.2.3. Структура і властивості льоду. Роль льоду в забезпеченні стабільності харчових продуктів
Молекула води при кристалізації утворює лід, який має гексагональну кристалічну решітку. Однак, лід за певних умов може існувати і в дев'яти інших кристалічних поліморфних модифікаціях. Заморожування є найбільш поширеним способом консервування (збереження) багатьох харчових продуктів. Необхідний ефект при цьому досягається більшою мірою від впливу низької температури, але також і від утворення кристалів льоду. Утворення льоду в клітинних структурах харчових продуктів і гелях має два важливих наслідки:
1) під час заморожування вода переходить в кристали льоду досить високого ступеня чистоти. Всі неводні компоненти при цьому концентруються в зменшеній кількості води, що не замерзла. Ці зміни можуть збільшити швидкості хімічних реакцій. Таким чином, заморожування має два протилежних впливи на швидкість реакцій:
- зниження температури сповільнює хімічні реакції,
- збільшення концентрації компонентів в незамерзаючій воді може іноді їх прискорювати (за принципом Ле-Шательє).
Проте, в цілому, швидкість хімічних реакцій при заморожуванні харчових продуктів сповільнюється.
2) Об‘єм води, що перетворюється на лід, збільшується приблизно на 9%. При цьому відбувається значна деформація або навіть руйнування клітинних структур, в тому числі і мікробіальних клітин. При цьому може відбуватися загибель мікробіальної клітини, або суттєво знижується її активність. Найбільш стійкими при заморожуванні виявляються спори мікроорганізмів, що містять досить низьку кількість вологи.
Слід зазначити, що структура льоду не ідеальна. Він містить мікротріщини, в яких можлива дифузія молекул води, що не замерзла. Цей факт має певне відношення до швидкості псування харчових продуктів і біологічних речовин в умовах зберігання за низьких температур.