
Главная страница Случайная страница
КАТЕГОРИИ:
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Теоретическая часть. Углекислый газ, угольная кислота и её соли – постоянные компоненты природных вод
|
|
Углекислый газ, угольная кислота и её соли – постоянные компоненты природных вод. Содержание свободной угольной кислоты Н2СО3 зависит от концентрации растворенной двуокиси углерода. В форме угольной кислоты находится лишь незначительная часть растворенного углекислого газа (около 1%), поэтому содержание свободной углекислоты в воде характеризуют суммой СО2 + Н2СО3. Существующее между различными формами угольной кислоты равновесие выражается химическими уравнениями:


 СО2+Н2О Н2СО3 Н+ + НСО3- Н+ + СО32- (Мингулина, 1990).
СО2+Н2О Н2СО3 Н+ + НСО3- Н+ + СО32- (Мингулина, 1990).
Из уравнений диссоциации угольной кислоты следует, что соотношение между её формами зависит от концентрации водородных ионов. При значении рН < 4, 3 вся углекислота находится в воде в виде СО2 и Н2СО3; с увеличением значения рН доля СО2 уменьшается при одновременном увеличении доли НСО3- , и при значении рН = 8, 35 практически вся углекислота присутствует в форме бикарбонат-ионов. При значении рН > 12 она представлена только ионами СО32- (рис 2).
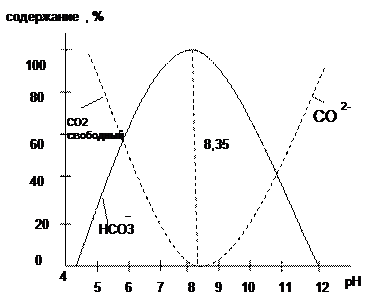
Рис.2. Зависимость содержания отдельных компонентов карбонатной системы от рН раствора.
Воду с фактическим содержанием СО2, равным её расчетной по уравнению равновесной концентрации, называют стабильной. При содержании СО2, большем равновесной концетрации, возможно растворение СаСО3 при контакте воды, например, с доломитовыми или известняковыми породами, бетонными сооружениями, поэтому такую воду называют агрессивной.
Наоборот, при недостатке СО2 будет наблюдатся распад бикарбонатов с образованием дополнительного количества твердой фазы карбоната кальция. Такую воду называют нестабильной:
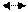 Са2+(водн) + 2НСО3-(водн) СаСО3(тв) + СО2(г) + Н2О(ж)
Са2+(водн) + 2НСО3-(водн) СаСО3(тв) + СО2(г) + Н2О(ж)
Фактические значения рН, определенные экспериментально, могут быть больше или меньше равновесного значения рН. Разность между экспериментально найденным и равновесным значением рН называется индексом стабильности воды (U). При U=0 вода стабильна, при U> 0 она нестабильна и способна к образованию отложений, при U< 0 вода агрессивна (Мешалкин, 2007).