
Главная страница Случайная страница
КАТЕГОРИИ:
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Распад глюкозы регулируется ключевыми метаболитами и подчинен комплексной системе контроля
|
|
В гликолизе и ЦТК действуют несколько ключевых реакций, благодаря которым весь процесс окисления глюкозы от начала до конца является контролируемым. Наиболее важная точка контроля — реакции гликолиза, связанные с I превращением фруктозо-6-фосфата во
фруктозо-1, 6-бисфосфат и обратно. Все ферменты, участвующие в прямой и обратной реакциях, подвержены аллостерической регуляции (рис. 4.6). В клетках животных АТФ-зависимая фосфофруктокиназа активируется АДФ и подавляется АТФ, тогда как в клетках растений этот фермент активируется ионом фосфата, а ингибируется ФЕП. Обратная реакция, катализируемая фосфатазой, в обоих случаях активируется АТФ и цитратом и подавляется АДФ. Такая система регуляции означает, что накопление в клетке нереализованного АТФ и фосфоенолпирувата на фоне низкого уровня АДФ и Фн приведет к подавлению активности фосфофруктокиназы и активации фосфатазы, т.е. к торможению скорости распада глюкозы.
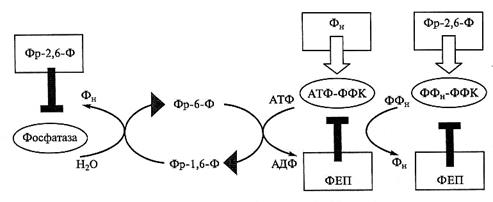
Рис. 4.6. Регуляция гликолиза у растений на уровне реакции фосфорилирования фруктозо-6-фосфата:
Фр-6-Ф — фруктозо-6-фосфат; Фр-1, 6-Ф — фруктозо-1, 6-бисфосфат; Фр-2, 6-Ф — фруктозо-2, 6-бисфосфат; АТФ-ФФК — АТФ-зависимая фосфофруктокиназа; ФФН-ФФК — пирофосфат-зависимая фосфофруктокиназа; фосфатаза — фруктозо-1, 6-бисфосфатаза;  — активирование;
— активирование;
┴ — ингибирование
В регуляцию этих реакций включен еще один фактор — фруктозо-2, 6-бисфосфат, регуляторная молекула у всех эукариот. Фруктозо-2, 6-бисфосфат действует как активатор прямой и ингибитор обратной реакции, т. е. стимулирует гликолиз и подавляет глюконеогенез. У животных фруктозо-2, б-бисфосфат активирует АТФ-зависимую фосфофруктокиназу и подавляет активность фосфа-тазы. У растений в отличие от животных фруктозо-2, 6-бисфосфат не действует на АТФ-зависимый фермент, но четко активирует ФФн-зависимую фосфофруктокиназу и ингибирует фосфатазу. Пластидная изоформа АТФ-зависимой фосфофруктокиназы, как и цитозольная, активируется фосфатом и подавляется ФЕП, а также АТФ. О способах регуляции пластидной фосфатазы известно мало.
Фруктозо-2, 6-бисфосфат образуется и деградирует при участии двух ферментов: фруктозо-6-фосфат 2-киназы и фруктозо-2, 6-бисфосфатазы:
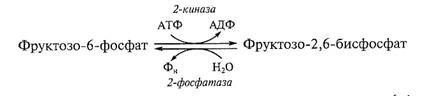
Активность 2-киназы активируется ионом фосфата и фруктозо-6-фосфатом и ингибируется трехуглеродным продуктом гликолиза — ФГА и ФГК. Таким образом, синтез самой регуляторной молекулы сложным образом зависит от соотношения С6/СЗ-Сахаров в растительной клетке. На это соотношение будут влиять интенсивность синтеза сахарозы и транспорт в хлоропласт Фн в обмен на триозофосфат (см. гл. 3).
Второй регуляторный фермент гликолиза, пируваткиназа, аллостерически ингибируется метаболитами ЦТК, цитратом и малатом и активируется АДФ и Фн.
Следующая точка контроля на пути окисления глюкозы — ПДК, на примере которого можно видеть, как иногда сложно регулируется активность ключевых ферментов. Одним из способов «быстрого реагирования» в клетке является изменение активности ферментов за счет их обратимого фосфорилирования—дефосфорилирования при участии специальных протеинкиназ и фосфатаз. Именно такому способу регуляции подвержен и ПДК: АТФ-зависимое фосфорилирование комплекса по остатку серина подавляет его активность, а при отщеплении фосфатной группы активность восстанавливается (рис. 4.7). Состояние комплекса зависит от активности киназы, которая в свою очередь подвержена аллостерической регуляции. Киназа активируется АТФ и ионом аммония и ингибируется субстратом комплекса — пируватом. Регуляторные свойства фосфатазы остаются пока неясными. Кроме того, ПДК ингибируется по типу обратной связи НАДН и ацетил-СоА.
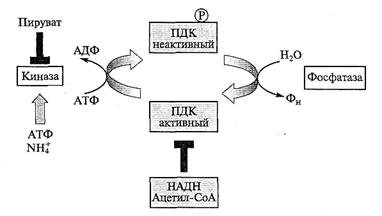
Рис. 4.7. Регуляция пируватдегидрогеназного комплекса за счет обратимого фосфорилирования/дефосфорилирования.
Киназа катализирует АТФ-зависимое фосфорилирование одного из белков комплекса, переводя его в неактивное состояние. Киназа активируется АТФ и ионами аммония, ингибируется пируватом. Дефосфорилирование при участии фосфатазы восстанавливает активность комплекса. Кроме того, активность ПДК подавляется продуктами реакции — НАДН и ацетил-СоА; ┴ — ингибирование;  — активирование
— активирование
Регуляторные ферменты ЦТК — цитратсинтаза и НАД-зависимая изоцитратдегидрогеназа. Активность цитратсинтазы аллостерически подавляется АТФ и НАДН. Изоцитратдегидрогеназа активируется АДФ и цитратом и ингибируется АТФ и НАДН. Кроме того, работа дегидрогеназ цикла зависит от соотношения НАД 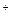 /НАДН в матриксе. Следовательно, ключевую роль в управлении ЦТК играет соотношение НАДН/НАД+ и АТФ/АДФ в матриксе митохондрий. При высоком содержании АТФ и НАДН работа цикла будет тормозиться.
/НАДН в матриксе. Следовательно, ключевую роль в управлении ЦТК играет соотношение НАДН/НАД+ и АТФ/АДФ в матриксе митохондрий. При высоком содержании АТФ и НАДН работа цикла будет тормозиться.
Итак, на всем пути окисления глюкозы действуют ферменты, активность которых сложным образом зависит от многих факторов. В то же время в системе регуляции прослеживается общий принцип: ключевые реакции регулируются «снизу вверх», т. е. метаболитами, которые образуются в последующих реакциях, и прежде всего на заключительной стадии, когда в процессе окислительного фосфорилирования синтезируется основная масса АТФ из АДФ и Фн. Во всех случаях ключевые ферменты реагируют либо на абсолютное содержание, либо на соотношение АДФ, АТФ и Фн. Такая система регуляции очень логична и направлена на поддержание в клетке режима экономии, при котором скорость распада глюкозы соответствовала бы потребностям клетки в АТФ и других продуктах дыхания. При высоком уровне АДФ и Фн, который отражает быстрый расход в клетке синтезируемой АТФ, ключевые реакции гликолиза и ЦТК активируются, а при накоплении АТФ тормозятся. Благодаря такой системе регуляции скорость окисления глюкозы и дыхания в целом координируется в соответствии с энергетическим статусом клетки.