
Главная страница Случайная страница
КАТЕГОРИИ:
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Влияние температуры на скорость химических реакций
|
|
Повышение температуры ускоряет большинство химических реакций. Приближенно влияние температуры на скорость реакции описывает эмпирическое правило Вант-Гоффа: при повышении температуры на каждые 10 градусов скорость для большинства реакций увеличивается в 2¸ 4 раза.
V2 = V1× 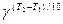 , (4)
, (4)
где V1, V2 – скорости реакции при температурах Т1 и Т2; g - температурный коэффициент Вант-Гоффа, который показывает во сколько раз увеличивается скорость реакции при повышении температуры на каждые 100 (в интервале температур от комнатных до 400°С).
Точнее значение g можно вычислить по формуле:
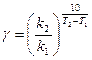 , (5)
, (5)
где k 1, k 2 – константы скорости реакции при температурах Т1 и Т2.
Небольшое значение температурного коэффициента обусловливает большое возрастание скорости реакции при незначительном повышении температуры. Например, если γ = 2, 9, то при возрастании температуры на 1000 скорость реакции увеличится в 2, 910 раза, т.е. приблизительно в 42 000 раз.
Такое большое увеличение скорости реакции можно было бы объяснить возрастанием числа соударений между молекулами. Однако кинетическая теория показывает, что увеличение скорости, вызванное увеличением числа столкновений с ростом температуры, совсем незначительное и не может обеспечить наблюдающегося резкого возрастания скорости. Всё это приводит к выводу, что не каждое соударение молекул эффективно, и химическое взаимодействие имеет место, только если сталкивающиеся молекулы обладают определенным избытком энергии по сравнению со средней энергией данных молекул. Эта избыточная энергия называется энергией активации (EА), а молекулы, обладающие этой избыточной энергией, - активными. Величина энергии активации зависит от природы реагирующих веществ. Для большинства химических реакций значения Е А лежат в пределах 40¸ 400 кДж/моль. В узком интервале температур энергия активации практически не зависит от температуры и может быть вычислена по уравнению Аррениуса:
k = Аe(-Е/RT) (6)
где k – константа скорости реакции; А – постоянная, характеризующая каждую конкретную реакцию (константа Аррениуса); Е – энергия активации; R – газовая постоянная (8, 314 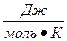 ); Т – температура, К (Кельвин).
); Т – температура, К (Кельвин).
Обратите внимание: уравнение (6) связывает температуру не со скоростью реакции, а с константой скорости.
Уравнение (6) для температур Т1 и Т2 может быть записано после преобразований в удобной для вычислений форме (7а или 7б):
Е = 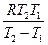 ∙ ln
∙ ln 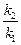 (7а) Е =
(7а) Е =  ∙ lg
∙ lg 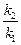 (7б)
(7б)
где k1 и k2 – константы скорости реакции при температурах Т1 и Т2, К
При повышении температуры энергия вещества возрастает и перераспределяется между молекулами таким образом, что значительно возрастает число активных молекул.
Источником энергии активирования может быть энергия в различных формах: тепловая, лучистая, электрическая, энергия радиоактивных частиц и т.д. Если энергия активации очень мала (меньше 40 кДж/моль), это означает, что значительная часть столкновений между частицами реагирующих веществ приводит к реакции. При этом скорость такой реакции будет большой. Напротив, если энергия активации очень велика (больше 120 кДж/моль), то это означает, что очень малая часть столкновений взаимодействующих частиц приводит к химической реакции. Скорость реакции очень мала.
Примером реакции, имеющей высокую энергию активации, является реакция синтеза аммиака:
 N2 + 3Н2 2NН3
N2 + 3Н2 2NН3

Эта реакция при обычных температурах протекает столь медленно, что заметить её протекание практически невозможно.
Большую роль в снижении энергии активации играют катализаторы.