
Главная страница Случайная страница
КАТЕГОРИИ:
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Химическое равновесие. Все химические реакции делятся на необратимые и обратимые.
|
|
Все химические реакции делятся на необратимые и обратимые.
Необратимые химические реакции – это реакции, протекающие только в одном направлении. Химическая реакция будет необратимой, если она подчиняется правилу Бертолле – Михайленко: Обменная реакция идет до конца в сторону образования малорастворимого вещества (осадка или газа), слабых электролитов и комплексных ионов.
Необратимых реакций не много, н-р:
Na2CO3 + H2SO4 ═ Na2SO4 + CO2↑ + H2O 2КI + HgI2 = К2 [НgI4]
BaCl2 + H2SO4 ═ BaSO4↓ + 2HCl КОН + НCl = КСl + Н2
Необратимые реакции протекают до конца, т.е. до полного расходования одного из реагирующих веществ.
Большинство реакций являются обратимыми. Обратимые химические реакции – это реакции, которые при одних и тех же условиях (температура и давление) могут протекать в противоположных направлениях. Обратимые реакции не идут до конца, так как продукты реакции, взаимодействуя между собой, вновь дают исходные вещества, н-р:



 3Н2 + N2 2NН3 2Н2 + О2 2Н2О
3Н2 + N2 2NН3 2Н2 + О2 2Н2О
 Обратимость реакции отмечается знаком двух стрелок, направленных в противоположные стороны.
Обратимость реакции отмечается знаком двух стрелок, направленных в противоположные стороны.
Для любой обратимой реакции существует скорость прямой реакции (Vпрям) и скорость обратной реакции (Vобр). В соответствии с законом действующих масс для реакции

 mА + nВ pС + qD
mА + nВ pС + qD
Vпрям = k1 • (СА)m • (СВ)n, где k1 – константа скорости прямой реакции;
СА и СВ – молярные концентрации веществ А и В.
Vобр = k2 • (СС)p • (СD)q, где k2 – константа скорости обратной реакции;
СС и СD – молярные концентрации веществ C и D.
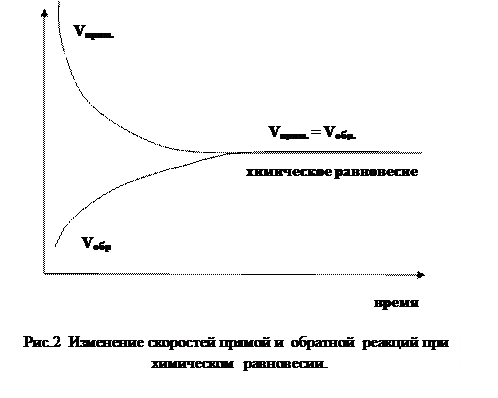
По мере взаимодействия исходных веществ А и В их начальные концентрации уменьшаются; следовательно, постепенно уменьшается начальная скорость прямой реакции Vпрям. По мере накопления продуктов реакции C и D концентрации их увеличиваются; следовательно, скорость обратной реакции Vобр постепенно увеличивается. Наконец, наступает такой момент (рис.2), когда скорость прямой реакции Vпрям становится равной скорости обратной реакции Vобр.
Состояние обратимой реакции, при котором скорости прямой и обратной реакции равны, называется химическим равновесием.
Состояние химического равновесия характеризуется тем, что концентрация исходных и конечных продуктов реакции при данных температуре и давлении остается постоянной. Т.е., при установлении равновесия в единицу времени образуется такое количество веществ C и D, какое в это же время распадается с образованием веществ А и В.
Таким образом, химическое равновесие является динамическим (подвижным): в момент равновесия химическое взаимодействие не прекращается, а продолжает идти с одинаковой скоростью в обоих направлениях.
  |
Концентрации реагирующих веществ, которые устанавливаются при химическом равновесии, называются равновесными концентрациями. Их обозначают при помощи квадратных скобок, н-р: [Н2], [I2], [НI] в отличие от неравновесных концентраций, обозначаемых СН2, СI2, СНI.
При установившемся равновесии Vпрям = Vобр для обратимого процесса
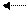
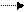 mА + nВ pС + qD
mА + nВ pС + qD
k1 • [А]m • [В]n = k2 • [С]p • [D]q
Откуда 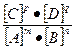 =
= 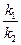 = К
= К
где К – константа химического равновесия. Это уравнение - математическая запись закона действующих масс для химического равновесия.