
Главная страница Случайная страница
КАТЕГОРИИ:
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Константа химического равновесия
|
|
Если все участники реакции являются газообразными веществами, то вместо равновесных концентраций удобнее пользоваться равновесными парциальными давлениями компонентов Р А, Р В, Р Си Р D, тогда закон действующих масс примет вид: 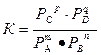
Обратите внимание. Для гетерогенных реакций закон действующих масс выполняется при условии, что в уравнения констант равновесия не входят равновесные концентрации (парциальные давления) твердых исходных веществ и продуктов реакции. Н-р, для гетерогенной реакции:
Сграфит + 2Н2Огаз «СО2 + 2Н2
константа равновесия К выражается уравнением:
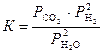 .
.

 Для реакции: 3Fe + 4H2Oпар Fe3O4 + 4H2 К =
Для реакции: 3Fe + 4H2Oпар Fe3O4 + 4H2 К = 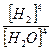 .
.
Константа равновесия представляет собой отношение констант скоростей прямой и обратной реакций К = 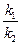 . Константа химического равновесия зависит от природы реагирующих веществ, от температуры и давления. Влияние температуры на К определяется знаком теплового эффекта реакции. Связь между температурой и константой равновесия реакции (при р = const) отражает уравнение изобары Вант-Гоффа:
. Константа химического равновесия зависит от природы реагирующих веществ, от температуры и давления. Влияние температуры на К определяется знаком теплового эффекта реакции. Связь между температурой и константой равновесия реакции (при р = const) отражает уравнение изобары Вант-Гоффа:
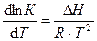 , (8)
, (8)
где l n К – натуральный логарифм константы равновесия; D Н – изменение энтальпии реакции; R – универсальная газовая постоянная; Т –абсолютная температура, К. Для эндотермической реакции (Q< 0, DН > 0) при повышении температуры константа равновесия увеличивается, и наоборот, для экзотермической реакции (Q > 0, DН < 0) при возрастании температуры К уменьшается. Из уравнения видно, что при увеличении абсолютного значения энтальпии реакции и уменьшении температуры чувствительность К к изменению температуры повышается. Используя уравнение изобары Вант-Гоффа, можно вывести формулу для расчета среднего значения D Н реакции, если известны значения константы равновесия при двух температурах (8а):
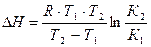 (8а)
(8а)
где К 1, К 2 – константы равновесия реакции при температурах Т 1 и Т 2 соответственно.
Стандартное изменение энергии Гиббса Δ G0 реакции связано с К реакции уравнением (9):
Δ G0 = - RT ln К = - 2, 303 RT lg К, (9)
где R - универсальная газовая постоянная 8, 314 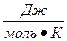 ; Т – абсолютная температура, К; К – значение константы равновесия.
; Т – абсолютная температура, К; К – значение константы равновесия.
Это уравнение (9) даёт возможность, зная Δ G0, вычислять константу равновесия, и, наоборот, по экспериментально найденному значению К определять Δ G0 реакции.
Константа равновесия К не зависит от начальной концентрации реагирующих веществ. Чем больше К, тем больше концентрация конечных продуктов в момент равновесия. Она показывает, во сколько раз прямая реакция идет быстрее обратной при одинаковой температуре и концентрациях, равных единице.
Н-р, для реакции: 
 А + В С + D
А + В С + D
Если К равна 10-6, то это означает, что произведение равновесных концентраций продуктов реакции в 1 000 000 раз меньше произведения концентраций ис-ходных продуктов реакции. Следовательно, равновесие сдвинуто в левую сторону, т.е. указанная реакция протекает справа налево.
Если К равна 106, то это означает, что произведение концентраций конечных продуктов реакции в 1 000 000 раз больше произведения концентраций исходных продуктов реакции. Следовательно, равновесие в этом случае будет сдвинуто в правую сторону, т.е. указанная выше реакция протекает слева направо.
Закон действующих масс в применении к обратимым реакциям можно сформулировать следующим образом:
При постоянной температуре отношение произведения равновесных концентраций продуктов реакции в степенях, равных стехиометрическим коэффициентам, к произведению равновесных концентраций исходных веществ в степенях, равных стехиометрическим коэффициентам, является величиной постоянной.
Зная равновесные концентрации, легко вычислить константу равновесия и исходные концентрации реагирующих веществ.