
Главная страница Случайная страница
КАТЕГОРИИ:
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Катализ и катализаторы
|
|
Катализ – ускорение химических реакций за счёт введения в реакционную среду специальных веществ – катализаторов. Катализатор – это вещество, которое ускоряет протекание химической реакции, но само при этом не расходуется. Катализ подразделяется на два типа:
А) Гомогенный катализ - реагирующие вещества и катализатор находятся в одном агрегатном состоянии (жидком или газообразном).
Б) Гетерогенный катализ - реагирующие вещества и катализатор находятся в разных агрегатных состояниях (чаще всего катализатор является твердым телом, а реагирующее вещество – газ или жидкость), при этом реакция протекает на поверхности катализатора. Гетерогенный катализ тесно связан с адсорбцией.
4.1 Адсорбция – это экзотермический процесс самопроизвольного концентрирования вещества из объёма фаз на поверхности раздела между ними.
Вещества, на поверхности которых происходит адсорбция, называются адсорбентами. Адсорбируемые вещества называются адсорбатами. С точки зрения характера связи, возникающей между адсорбентом и адсорбатом, различают:
А) Физическая адсорбция - молекулы поглощаемого вещества удерживаются поверхностью адсорбента слабыми межмолекулярными силами притяжения. При постоянной температуре устанавливается динамическое равновесие между адсорбцией и десорбцией. Возможна на любых поверхностях.
Б) Химическая адсорбция (хемосорбция) – взаимодействие молекул с поверхностью твердых тел с помощью химических связей. Она происходит лишь на «избранных» адсорбентах. Хемосорбция - процесс необратимый.
4.2 Механизм действия катализаторов является очень сложным. Основная гипотеза, объясняющая катализ – это образовании промежуточных продуктов при взаимодействии катализаторов и реагирующего вещества. Если реакция А + В = АВ без катализатора происходит медленно, то при добавлении катализатора К он реагирует с одним из исходных веществ, образуя непрочное и очень реакционноспособное промежуточное соединение АК (или ВК):
А(В) + К = АК (ВК)
Промежуточное соединение АК взаимодействует с другим исходным веществом В, образуя конечный продукт реакции АВ и выделяя катализатор К в первоначальном виде:
АК + В = АВ + К
Механизм действия катализатора заключается в том, что он изменяет «путь» процесса реагенты → продукты, причём новый путь характеризуется меньшей энергией активации (Е ') по сравнению с энергией активации Е некатализируемой реакции (рис.1) Величина Δ Е служит критерием эффективности катализатора.
Увеличение скорости реакции в присутствии катализатора можно оценить по уравнению:
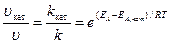 ,
,
где Vкат, k кат – скорость и константа скорости реакции в присутствии катализатора; V, k –скорость и константа скорости реакции без катализатора; Е А, кат, Е А – энергия активации реакции в присутствии катализатора и без него.
4.3 Отравление и промотирование. Одним из важнейших отличий гетерогенных катализаторов от гомогенных является зависимость их свойств от условий приготовления и высокая чувствительность к действию небольших примесей инородных веществ. При этом наблюдается ряд эффектов, к которым относятся:
А) Отравление – это уменьшение активности катализатора под действием особых веществ - ядов. Различают:
В некоторых случаях одни и те же вещества могут быть ядами по отношению к одним катализаторам и не отравлять другие. Н-р, кислород отравляет железо в синтезе аммиака, но активирует платиновые катализаторы при окислении водорода.
Б) Промотирование – это активация катализатора под действием примеси. Она может быть обусловлена увеличением работающей поверхности катализатора или изменением природы активных центров. Примером первого типа является примесь Al2O3 в железном катализаторе при синтезе аммиака, а второго типа – примесь К2О для того же катализатора.
Вещества, которые ускоряют протекание реакций в живых системах, называются биокатализаторами, или ферментами, или энзимами. Вещества, которые тормозят протекание химических реакций, называются ингибиторами.
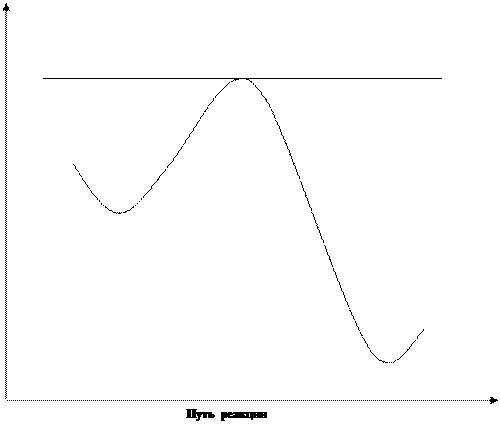
Q


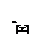

рис.1 Снижение энергии активации при каталитической реакции