
Главная страница Случайная страница
КАТЕГОРИИ:
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Мольных энергии Гиббса, энтропии и энтальпии реакции
|
|
| Вещество |  кДж/моль
кДж/моль
| 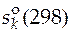 Дж/(моль∙ К)
Дж/(моль∙ К)
|  кДж/моль
кДж/моль
|
6. Произвести расчет изменения стандартных мольных экстенсивных свойств за счет протекания итоговой реакции в гальваническом элементе по справочным данным.
6.1. Стандартную мольную энтропию реакции находят по формуле
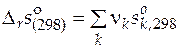 , (52)
, (52)
где 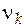 − стехиометрическое число вещества в данной реакции;
− стехиометрическое число вещества в данной реакции;
 − стандартная мольная энтропия чистого вещества k при 298 К.
− стандартная мольная энтропия чистого вещества k при 298 К.
6.2. Для расчета стандартной мольной энтальпии и стандартной мольной энергии Гиббса итоговой реакции используют формулы
 ;
; 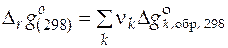 , (53)
, (53)
где 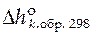 − стандартная мольная энтальпия образования чистого вещества k из простых веществ при 298 К;
− стандартная мольная энтальпия образования чистого вещества k из простых веществ при 298 К;
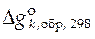 − стандартная мольная энергия Гиббса образования чистого вещества k из простых веществ при 298 К.
− стандартная мольная энергия Гиббса образования чистого вещества k из простых веществ при 298 К.
7. Сравнить значения величин, полученные в п.4 и п.6.
3.3. Алгоритм выполнения задания С
1.Сформулировать цели этого вида задания. Изложить теоретический материал по возможности определения среднего ионного коэффициента активности электролита с использованием исследуемого гальванического элемента.
1.1.Привести схему гальванического элемента и уравнение итоговой реакции.
1.2. Записать уравнение Нернста для итоговой реакции и преобразовать его к виду, удобному для графического нахождения величины стандартной ЭДС гальванического элемента при температуре, указанной в задании. Пример преобразований для гальванических элементов, указанных в табл. 1 приведен далее в табл. 5.
Таблица 5