
Главная страница Случайная страница
КАТЕГОРИИ:
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Библиографический список. 1. Краснов К. С. Физическая химия: учеб
|
|
1. Краснов К.С. Физическая химия: учеб. для вузов: в 2 кн. / К.С. Краснов [и др.]; под общ. ред. К.С. Краснова; 2-е изд., перераб. и доп. М.: Высш. шк., 2000. Кн. 1. − 512 с.
2. Стромберг А.Г. Физическая химия / А.Г. Стромберг, Д.П.Семченко; под ред. А.Г.Стромберга; 5-е изд., испр. М.: Высш. шк., 2003. − 527 с.
3. Краткий справочник физико-химических величин /под ред. А.А.Равделя и А.М.Пономаревой. Л.: Химия, 2003. 232 с.
4. Байрамов В.М. Основы электрохимии / В.М.Байрамов. М.: Издательский центр «Академия», 2005. – 240 с.
5. Расчет ионных равновесий: Учебное пособие/ Степановских Е.И., Больщикова Т.П., Урицкая А.А. Екатеринбург: УГТУ− УПИ, 2007. − 65 с.
6. Электрохимия: Учебное пособие - практикум для лабораторных работ/ Т.П. Больщикова, Е.И. Степановских, А.А.Урицкая, А.Б. Лундин, Н.К.Булатов, Т.В. Виноградова. - Екатеринбург: УГТУ− УПИ, 2007. − 92 с.
7. Дамаскин Б.Б. Электрохимия: учеб. пособие / Б.Б. Дамаскин, О.А.Петрий. М.: Высш. шк., 1987. − 295 с.
Приложение
Таблица П.1
ТЕРМОДИНАМИЧЕСКИЕ СВОЙСТВА НЕКОТОРЫХ СОЕДИНЕНИЙ
И ИОНОВ В ВОДНЫХ РАСТВОРАХ
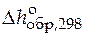 ,
, 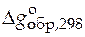 - стандартные мольные изменения энтальпии и энергии Гиббса при образовании данного вещества из простых веществ, термодинамически устойчивых при 101, 325 кПа (1 атм) и при выбранной температуре 298 К.
- стандартные мольные изменения энтальпии и энергии Гиббса при образовании данного вещества из простых веществ, термодинамически устойчивых при 101, 325 кПа (1 атм) и при выбранной температуре 298 К.
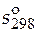 - стандартная мольная энтропия чистого вещества при 298 К.
- стандартная мольная энтропия чистого вещества при 298 К.
| Вещество |
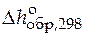 ,
кДж/моль ,
кДж/моль
| 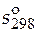 ,
Дж/(моль∙ К) ,
Дж/(моль∙ К)
| 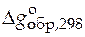 ,
кДж/моль ,
кДж/моль
|
| Ag (кр) | 42, 55 | ||
| AgBr (кр) | − 100, 42 | 107, 11 | − 97, 02 |
| AgCl (кр) | − 126, 78 | 96, 23 | − 109, 54 |
| AgI (кр) | − 61, 92 | 115, 48 | − 66, 38 |
| Ag2SO4 (кр) | − 715, 88 | 200, 00 | − 617, 36 |
| Cd (кр) | 51, 76 | ||
| Сu (кр) | 33, 14 | ||
| CuCl (кр) | − 137, 24 | 87, 02 | − 118, 09 |
| Fe (кр) | 27, 15 | ||
| Н2 (г.) | 130, 52 | ||
| Hg (ж) | 75, 90 | ||
| Hg2Br2 (кр) | − 207, 07 | 217, 70 | − 181, 35 |
| Hg2Cl2 (кр) | − 265, 06 | 192, 76 | − 210, 81 |
| Hg2SO4 (кр) | − 744, 65 | 200, 71 | − 625, 51 |
| Pb (кр) | 64, 81 | ||
| PbBr2 (кр) | − 282, 42 | 161, 75 | − 265, 94 |
| PbCl2 (кр) | − 359, 82 | 135, 98 | − 314, 56 |
| PbI2 (кр) | − 175, 23 | 175, 35 | − 178, 06 |
Окончание табл. П.1
| PbSO4 (кр) | − 920, 48 | 148, 57 | − 813, 07 |
| Sn (rр) | 51, 55 | ||
| Zn (кр) | 41, 63 | ||
| H+(aq) | |||
| Br− (aq) | − 121, 5 | 82, 84 | − 104, 04 |
| Cd2+(aq) | − 75, 31 | − 70, 92 | − 77, 63 |
| Сl− (aq) | − 167, 07 | 56, 74 | − 131, 29 |
| Cu2+(aq) | 66, 94 | − 92, 72 | 65, 56 |
| I− (aq) | − 56, 9 | 106, 69 | − 51, 91 |
| Fe2+(aq) | − 87, 86 | − 113, 39 | − 84, 88 |
| Sn2+(aq) | − 10, 23 | − 25, 26 | − 26, 24 |
| SO42− (aq) | − 909, 26 | 18, 2 | − 743, 99 |
| Zn2+ (aq) | − 153, 64 | − 110, 62 | − 147, 16 |
Таблица П.2
КОНСТАНТЫ ИОНИЗАЦИИ СЛАБЫХ КИСЛОТ
И ОСНОВАНИЙ ПРИ 298 К
| Название | Формула | Константа ионизации |
| Азотистая | HNO2 | 5, 1× 10-4 |
| Акриловая | C3H4O2 | 5, 56× 10-5 |
| Бензойная | C7H6O2 | 6, 3× 10-5 |
| м- бромбензойная | C7H5O2Br | 1, 54× 10-4 |
| п- бромбензойная | C7H5O2Br | 1, 07× 10-4 |
| Валериановая | C5H10O2 | 1, 44× 10-5 |
| м- Гидроксибензойная | C7H6O3 | 8, 33∙ 10− 5 |
| п- Гидроксибензойная | C7H6O3 | 2, 85∙ 10− 5 |
| Гликолевая | C2H4O3 | 1, 48× 10-4 |
| Изовалериановая | C5H10O2 | 1, 73∙ 10− 5 |
| Изомасляная | C4H8O2 | 1, 42× 10-5 |
Окончание табл. П.2
| Каприловая | C8H16O2 | 1, 28× 10-5 |
| цис − Коричная | С9H8O2 | 1, 32∙ 10− 4 |
| транс − Коричная | С9H8O2 | 3, 65∙ 10− 5 |
| Масляная | C4H8O2 | 1, 51× 10-5 |
| Миндальная | C8H8O3 | 3, 88× 10-4 |
| Молочная | C3H6O3 | 1, 37× 10-4 |
| Муравьиная | CH2O2 | 1, 772× 10-4 |
| м- нитробензойная | C7H5O4N | 3, 21× 10-4 |
| п- нитробензойная | C7H5O4N | 3, 76× 10-4 |
| Пропионовая | C3H6O2 | 1, 34× 10-5 |
| Уксусная | C2H4O2 | 1, 754× 10-5 |
| Фенилукусная | C8H8O2 | 4, 87× 10-5 |
| Фтористоводородная | HF | 6, 61× 10-4 |
| м − Фторбензойная | C7H502F | 1, 36∙ 10− 4 |
| o − Фторбензойная | C7H502F | 5, 41∙ 10− 4 |
| п − Фторбензойная | C7H502F | 7, 23∙ 10− 5 |
| м − Хлорбензойная | C7H502Cl | 1, 5∙ 10− 4 |
| п − Хлорбензойная | C7H502Cl | 1, 06∙ 10− 4 |
| Аммоний гидроксид | NH4OH | 1, 77× 10-5 |
| Бензиламин | C7H9N∙ H2O | 2, 35× 10-5 |
| Бутиламин | C4H11N∙ H2O | 4, 57× 10-4 |
| Гидразин | N2H4× H2O | 1, 7× 10-6 |
| Диметиламин | C2H7N∙ H2O | 6, 0× 10-4 |
| Дипропиламин | (C3H7)2NH | 8, 2∙ 10− 4 |
| Диэтиламин | C4H11N∙ H2O | 9, 6∙ 10− 4 |
| Изоамиламин | (CH3)2CH(CH3)2NH2 | 4, 0∙ 10− 4 |
| Метиламин | CH5N∙ H2O | 4, 24× 10-4 |
| Метилдиэтиламин | (C2H5)2NCH3 | 2, 7∙ 10− 4 |
| Пропиламин | C3H9N∙ H2O | 5, 62× 10-4 |
| Триметиламин | C3H9N∙ H2O | 6, 31× 10-5 |
| Триэтиламин | (С2H5)3N | 7, 4∙ 10− 4 |
| Этаноламин | C2H7ON∙ H2O | 3, 0× 10-5 |
| Этиламин | C2H7N∙ H2O | 3, 18× 10-4 |
| Этилендиамин | H2N(CH2)2NH2 | 1, 15∙ 10− 4 |
Таблица П.3
СТАНДАРТНЫЕ ЭЛЕКТРОДНЫЕ ПОТЕНЦИАЛЫ ИСПОЛЬЗУЕМЫХ В КУРСОВОЙ РАБОТЕ ЭЛЕКТРОДОВ ПРИ 298 К
| Электрод | Реакция | 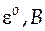
|
| H+| H2, Pt | H++ e → ½ H2 | 0, 000 |
| Zn2+| Zn | Zn2++ 2 e → Zn | − 0, 763 |
| Fe2+| Fe | Fe2++ 2 e → Fe | − 0, 440 |
| Cd2+| Cd | Cd2++ 2 e → Cd | − 0, 403 |
| I− | PbI2тв, Pb | PbI2 + 2 e → Pb + I− | − 0, 365 |
| SO42− | PbSO4тв, Pb | PbSO4 +2 e → Pb +SO42− | − 0, 359 |
| Br− | PbBr2тв, Pb | PbBr2 + 2 e → Pb + Br− | − 0, 284 |
| Cl− | PbCl2тв, Pb | PbCl2 + 2 e → Pb + Cl− | − 0, 268 |
| I− | AgIтв, Ag | AgI + e → Ag + I− | − 0, 152 |
| Sn2+| Sn | Sn2++ 2 e → Sn | − 0, 136 |
| Br− | AgBrтв, Ag | AgBr + e → Ag + Br− | +0, 071 |
| Cl− | CuClтв, Cu | CuCl + e → Cu + Cl− | +0, 137 |
| Br− | Hg2Br2тв, Hg | ½ Hg2Br2+ e → Hg + Br− | +0, 140 |
| Cl− | AgClтв, Ag | AgCl+ e → Ag + Cl− | +0, 222 |
| Cl− | Hg2Cl2тв, Hg | ½ Hg2Cl2+ e → Hg + Cl− | +0, 268 |
| Cu2+| Cu | Cu2++ 2 e → Cu | +0, 337 |
| SO42− | Hg2SO4тв, Hg | Hg2SO4 +2 e → 2Hg +SO42− | +0, 615 |
| SO42− |Ag2SO4тв, Ag | Ag2SO4 +2 e → 2Ag +SO42− | +0, 654 |
| СОДЕРЖАНИЕ | |
| 1.ТЕОРЕТИЧЕСКАЯ ЧАСТЬ 1.1. Общие сведения | |
| 1.2. Зависимость ЭДС гальванического элемента от активностей компонентов, участвующих в реакции | |
| 1.3. Связь ЭДС элемента с термодинамическими функциями, характеризующими реакцию, протекающую в гальваническом элементе | |
| 1.4. Применение метода ЭДС 1.4.1. Экспериментальное определение величины рН растворов | |
| 1.4.1.1. Определение рН с помощью водородного электрода | |
| 1.4.1.2. Определение рН с хингидронным электродом | |
| 1.4.1.3. Измерение рН стеклянным электродом | |
| 1.4.2. Определение констант ионизации слабых электролитов 1.4.2.1. Определение констант ионизации слабых электролитов методом рН-метрии | |
| 1.4.2.2. Определение константы ионизации слабой кислоты методом измерения ЭДС | |
| 1.4.2.3. Определение константы кислотности методом потенциометрического титрования | |
| 1.4.3. Определение средних ионных коэффициентов активности | |
| 2. ВАРИАНТЫ ЗАДАНИЙ НА КУРСОВУЮ РАБОТУ | |
| 3. АЛГОРИТМ ВЫПОЛНЕНИЯ КУРСОВОЙ РАБОТЫ 3.1. Алгоритм выполнения варианта А | |
| 3.2. Алгоритм выполнения варианта задания В | |
| 3.3. Алгоритм выполнения задания С | |
| 3.4. Алгоритм выполнения задания D | |
| 3.5. Алгоритм выполнения задания Е | |
| 4. РЕКОМЕНДАЦИИ ПО СОДЕРЖАНИЮ И ОФОРМЛЕНИЮ КУРСОВОЙ РАБОТЫ 4.1. Структура курсовой работы | |
| 4.2. Рекомендации по стилю написания и оформлению работы | |
| 5. БИБЛИОГРАФИЧЕСКИЙ СПИСОК | |
| ПРИЛОЖЕНИЕ |