
Главная страница Случайная страница
КАТЕГОРИИ:
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Примеры записи уравнений Нернста для графического
|
|
определения E о и средних ионных коэффициентов активности
| Схема гальванического элемента | Уравнение Нернста |
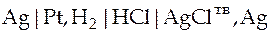
| 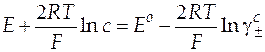
|
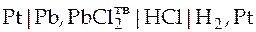
| 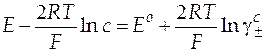
|
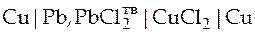
| 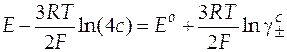
|
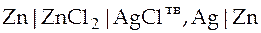
| 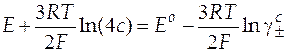
|
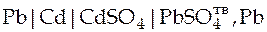
| 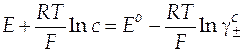
|
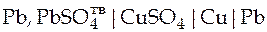
| 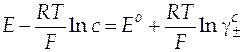
|
2. Определить величину стандартной ЭДС гальванического элемента при температуре, указанной в задания.
2.1. Сформировать вспомогательную таблицу для расчета величин, необходимых для дальнейшего графического определения стандартной ЭДС гальванического элемента при любой температуре. Таблица может иметь, например, такой вид (табл.6)
Таблица 6
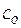 , моль/л , моль/л
| ||||||||||
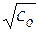
| ||||||||||
| А |
А − это выражение типа 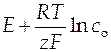 (или другое в зависимости от типа электродной реакции, см. табл. 5)
(или другое в зависимости от типа электродной реакции, см. табл. 5)
2.2. Построить графическую зависимость А от 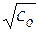 .
.
2.3. Экстраполяцией кривой до оси ординат определяют величину стандартной ЭДС гальванического элемента при температуре опыта. Зависимость А от 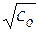 может быть разной и иногда она имеет максимум или минимум. Экстраполировать зависимость на нулевую ионную силу нужно только по участку кривой, приближающемуся к нулевой концентрации, а не усредняя данные по всему диапазону.
может быть разной и иногда она имеет максимум или минимум. Экстраполировать зависимость на нулевую ионную силу нужно только по участку кривой, приближающемуся к нулевой концентрации, а не усредняя данные по всему диапазону.
3. Определить средние ионные коэффициенты активности при концентрации раствора 0, 01, 005 и 0, 1 моль/л по формулам (43, 44).
4. Провести расчет средних ионных коэффициентов активности при концентрации раствора 0, 01, 005 и 0, 1 моль/л по теории Дебая-Хюккеля (формулы 45, 46).
5. Сопоставить полученные значения со значениями, определенными экспериментально.
3.4. Алгоритм выполнения задания D
1.Сформулировать цели этого вида задания. Изложить теоретический материал по возможности определения константы ионизации слабой кислоты (слабого основания) с использованием исследуемого гальванического элемента.
1.1.Привести схему гальванического элемента и уравнение итоговой реакции.
1.2. Записать уравнение Нернста для итоговой реакции и преобразовать его к виду, удобному для графического нахождения величины константы ионизации слабой кислоты.
2. Произвести необходимые для построения графика расчеты. Вычислить ионную силу растворов. Вычислить значения f (I) для каждой концентрации раствора слабой кислоты.
3. Изобразить зависимость f (I) от квадратного корня ионной силы раствора. Найти приближенное значение константы ионизации.
4. Сопоставить полученное значение со справочными данными. В случае большого расхождения провести повторное определение, учитывая концентрацию ионов гидроксония.
3.5. Алгоритм выполнения задания Е
1.Сформулировать цели этого вида задания. Изложить теоретический материал по возможности определения константы ионизации слабой кислоты (слабого основания) с использованием исследуемого гальванического элемента, а также с использованием метода рН-метрии.
Алгоритм выполнения задания при определении константы ионизации методом ЭДС совпадает с алгоритмом задания D. Затем нужно:
2. Перевести данные задания на курсовую к виду, удобному для графического определения константы ионизации методом рН-метрии.
3. Построить графическую зависимость и определить величины константы ионизации.
4. Сопоставить значения констант ионизации, полученные методом ЭДС и методом рН− метрии.