
Главная страница Случайная страница
КАТЕГОРИИ:
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Способы выражения концентрации
|
|
Для титрования в титриметрических методах анализа используют растворы с точно известной концентрацией, которые называют титрантамиили титрованными растворами. Концентрация титрованного раствора обозначается терминами молярная, титр или титр по определяемому веществу.
Молярная концентрация (моль/л)-это выраженное в молях количество растворенного вещества, содержащееся в одном литре раствора. Она вычисляется как отношение количества растворенного вещества к объему раствора в литрах (размерность - моль/л). Моль представляет собой количество вещества, содержащее столько специфицированных структурных единиц, сколько атомов содержится в 0, 012 кг (12 г) изотопа углерода - |2С.
В качестве специфицированных структурных единиц могут быть выбраны элементарные частицы, а также ионы, атомы, молекулы или их доли. В аналитической химии величину этих долей выбирают так, чтобы каждая из них была ответственна за передачу одного электрона в окислительно-восстановительной реакции или эквивалентна одному иону водорода в кислотно-основной реакции. Для обозначения такой доли иона, атома или молекулы принят термин «условная частица» (УЧ).
Например:
Раствор йода -0, 1 моль/л УЧ (1/2 I2);
Раствор натрия тиосульфата - 0, 1 моль/л УЧ (1/2 Na2S2O3);
Раствор калия бромата - 0, 1 моль/л УЧ (1/6 КвгО3).
При обозначении концентрации титрованного раствора в скобках указано, исходя из какой условной частицы (иными словами - эквивалента) он приготовлен. Молярная концентрация титрованных растворов рекомендована ИЮПАК и принята в ГФ XI.
Титр (Т) - это выраженная в граммах масса растворенного вещества, содержащаяся в одном миллилитре раствора. Титр вычисляют как отношение массы растворенного вещества к объему раствора (размерность - г/мл).
Титр титранта по определяемому веществу (Т титранта/опр. в-во)-это выраженная в граммах масса определяемого вещества, эквивалентная одному миллилитру данного титранта (размерность г/мл). Титр по определяемому веществу вычисляют, исходя из молярности по формуле:
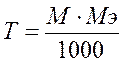
где М - молярная концентрация титранта; МЭ - молярная масса эквивалента определяемого вещества.
Молярной массой эквивалента вещества называют массу одного моля эквивалента этого вещества, равную произведению фактора эквивалентности (fЭ) на молярную массу определяемого вещества (М).
Фактор эквивалентности -это число, обозначающее, какая доля молекулы вещества эквивалентна одному иону водорода в данной кислотно-основной реакции или одному электрону в окислительно-восстановительной реакции.
Например, при титровании раствора водорода пероксида титрованным раствором калия перманганата fЭ (Н2О2) = 1/2:
5 Н2О2 + КМп04 + 3H2SO4 ® 2MnSO4 + 5О2 +K,, SO4 + 8Н2О
(02)2- - 2 е- ® 020 |5
Мп7++ 5е- ® Мп2+ | 2