
Главная страница Случайная страница
КАТЕГОРИИ:
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Гомогенных реакций
|
|
Гомогенные химические реакции протекают в объеме раствора.
По современному определению скорость химической реакции 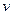 – изменение количества вещества (исходного или продукта)
– изменение количества вещества (исходного или продукта) 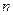 в единицу времени
в единицу времени  в единице объема
в единице объема 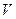 , рассчитанное на единицу его стехиометрического коэффициента (
, рассчитанное на единицу его стехиометрического коэффициента (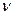 ):
):
 .
.
Например, для скорости реакции 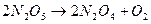 можно записать:
можно записать:  . Соотношение показывает, что скорость реакции не зависит от природы вещества.
. Соотношение показывает, что скорость реакции не зависит от природы вещества.
При протекании гомогенной химической реакции объем часто оказывается неизменным, и тогда 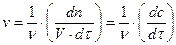 , т.е. скорость равна изменению концентрации любого из реагирующих веществ в единицу времени. При этом различают среднюю
, т.е. скорость равна изменению концентрации любого из реагирующих веществ в единицу времени. При этом различают среднюю 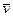 и истинную
и истинную 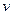 скорости реакции:
скорости реакции:
 (11)
(11)
и  . (12)
. (12)
Для оценки скорости можно использовать изменение физических свойств системы (давление, объем, электрические, оптические свойства и т.п.).
Скорость химической реакции по формулам (11) и (12) имеет размерность [ 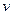 ] = [моль·м-3·с-1].
] = [моль·м-3·с-1].
Основной постулат химической кинетики (основной закон) сформулирован К. Гульдбергом и П. Ваге в 1879 г.: скорость реакции в каждый момент времени равна произведению текущих концентраций взаимодействующих веществ, возведенных в степени, равные их стехиометрическим коэффициентам. Иногда этот закон называют кинетической формой закона действующих масс, а чаще – основным кинетическим уравнением.
Для процесса 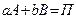 (
( - продукты реакции) основное кинетическое уравнение имеет вид:
- продукты реакции) основное кинетическое уравнение имеет вид:
при равной концентрации исходных веществ

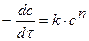 , (13)
, (13)
при неодинаковых концентрациях исходных веществ
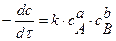 (14)
(14)
Коэффициент 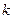 в уравнениях (13) и (14) называется константой скорости реакции. Её величина зависит от природы реакции, температуры, от вида и количества катализатора и не зависит от концентрации реагирующих веществ. Иногда константу скорости реакции называют единичной или удельной скоростью, так как по уравнению (13) видно, что
в уравнениях (13) и (14) называется константой скорости реакции. Её величина зависит от природы реакции, температуры, от вида и количества катализатора и не зависит от концентрации реагирующих веществ. Иногда константу скорости реакции называют единичной или удельной скоростью, так как по уравнению (13) видно, что  при концентрации, равной единице (
при концентрации, равной единице (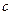 = 1).
= 1).
Размерность константы скорости зависит от показателя степени в кинетическом уравнении, который называется порядком реакции. Порядок реакции определяется уравнением реакции и равен сумме стехиометрических коэффициентов при концентрациях в этом уравнении. Так, в уравнении (13) порядок реакции соответствует величине 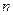 , а в уравнении (14) – равен сумме частных порядков по исходным веществам
, а в уравнении (14) – равен сумме частных порядков по исходным веществам 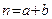 .
.
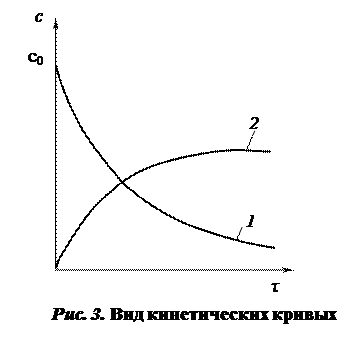 |
Кинетической кривой называют график изменения концентрации какого-либо участника реакции во времени
 (рис. 3).
(рис. 3).
Знак «±» перед скоростью в кинетическом уравнении используется для того, чтобы скорость реакции была всегда положительной величиной. Если концентрация вещества в ходе реакции убывает (кривая 1 на рис. 3), то используют знак минус и говорят о скорости по убыли вещества, если возрастает (кривая 2 на рис. 3) – используют знак плюс (скорость по прибыли).
В уравнение скорости реакции могут входить постоянные величины: концентрация катализатора, концентрация реагента, взятого в избытке и т.д., однако порядок реакции, форма уравнения для расчета констант скорости и времени прохождения половины реакции определяются только числом частиц реагентов, концентрация которых изменяется во времени.
Химическое превращение может быть простым или сложным и протекает в одну или несколько стадий; совокупность и последовательность стадий определяют механизм реакции. Число частиц (молекул, атомов, ионов), принимающих участие в одной стадии (иначе говоря, в одном элементарном реакционном акте), называется молекулярностью стадии. Существуют одно-, би- и реже тримолекулярные реакции. Порядок реакции является достаточно условным показателем. Для простых реакций порядок и молекулярность, как правило, совпадают. Вид кинетического уравнения нельзя предсказать, исходя из молекулярного уравнения реакции, так как оно описывает процесс в целом и не отражает истинного механизма реакции, а само кинетическое уравнение описывает химическое взаимодействие формально. Стехиометрическое уравнение может не совпадать с кинетическим порядком реакции. Одна и та же реакция может протекать по разному порядку в различных условиях. Например, разложение ряда органических веществ в парах протекает мономолекулярно при высоких давлениях газа, но переходит в реакцию второго порядка при понижении давления.
На рис. 4 показано, как с помощью графического дифференцирования находится истинная скорость химической реакции по тангенсу угла наклона касательной, проведенной к кинетической кривой в точке, связанной со временем, к которому относится эта скорость. В приведенном примере 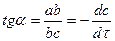 .
.
Среднюю скорость рассчитывают по уравнению (13) и связывают её со временем 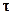 , средним для промежутка, в течение которого произошло изменение концентрации
, средним для промежутка, в течение которого произошло изменение концентрации  , и с концентрацией
, и с концентрацией  , средней за этот промежуток времени
, средней за этот промежуток времени 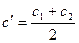 .
.
Для реакций первого порядка ( ) основное кинетическое уравнение имеет вид
) основное кинетическое уравнение имеет вид
 (15)
(15)
К реакциям такого типа относятся реакции изомеризации, разложения соединений в газовой фазе, процессы радиоактивного распада.
 |
Уравнение (15) можно переписать в виде 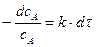 . Правую часть последнего уравнения обычно интегрируют от времени начала реакции
. Правую часть последнего уравнения обычно интегрируют от времени начала реакции  до некоторого время
до некоторого время  . Левую часть интегрируют от начальной концентрации
. Левую часть интегрируют от начальной концентрации  до текущей
до текущей  , т.е. до той концентрации, которая достигнута ко времени
, т.е. до той концентрации, которая достигнута ко времени  . После этого получаем выражение для константы скорости реакции
. После этого получаем выражение для константы скорости реакции  . Чаще уравнение записывают в виде:
. Чаще уравнение записывают в виде:
при расходовании вещества 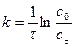 ; (16)
; (16)
при образовании продукта реакции  . (17)
. (17)
Размерность константы реакции первого порядка [ 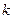 ] =
] =  , т.е. с-1, мин-1 и т.д. Уравнения (16) и (17) можно записывать в виде
, т.е. с-1, мин-1 и т.д. Уравнения (16) и (17) можно записывать в виде  и
и  , где
, где 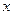 - расходованное количество, так называемая убыль концентрации реагирующего вещества, или количество вещества, образовавшееся в ходе реакции.
- расходованное количество, так называемая убыль концентрации реагирующего вещества, или количество вещества, образовавшееся в ходе реакции.
Многие гомогенные реакции в газовой и жидкой фазах относятся к реакциям второго порядка – разложение и образование йодоводорода, омыления этилацетата щелочью, димеризации циклопентадиена и др. Для них характерно уже два типа взаимодействий: 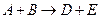 или
или  и, следовательно, два варианта расчетов. Для первой реакции, когда в реакцию вступают разные вещества, кинетическое уравнение примет вид:
и, следовательно, два варианта расчетов. Для первой реакции, когда в реакцию вступают разные вещества, кинетическое уравнение примет вид:
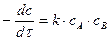 . (18)
. (18)
В общем случае основное кинетическое уравнение для реакций второго порядка имеет вид:
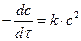 . (19)
. (19)
При равенстве начальных концентраций вступающих в реакцию веществ уравнение (18) переходит в уравнение (19). Интегральная форма основного кинетического уравнения имеет вид:
при расходовании 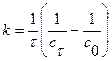 ; (20)
; (20)
при образовании продукта реакции 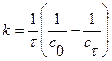 .
.
Если начальные концентрации реагирующих веществ не равны, то интегральная форма уравнения (18) имеет вид:
 , (21)
, (21)
где 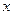 - убыль концентрации реагирующих веществ при условии пропорциональности взаимодействия.
- убыль концентрации реагирующих веществ при условии пропорциональности взаимодействия.
Размерность константы реакции второго порядка [ 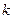 ] =
] = 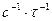 , т.е. (моль/дм3)-1·с-1 или моль-1∙ дм-3·с-1 и т.д. Размерность (моль/л)-1·мин-1 является устаревшей.
, т.е. (моль/дм3)-1·с-1 или моль-1∙ дм-3·с-1 и т.д. Размерность (моль/л)-1·мин-1 является устаревшей.
Для описания сложных химических реакций формальных представлений недостаточно. По фактическому механизму реакции подразделяются на гомолитические, когда при реакции электронная пара в химической связи разрывается (по гомолитическому типу протекают, например, окислительно-восстановительные реакции), и гетеролитические, когда оба электрона двухэлектронной химической связи переходят к одному из атомов. В зависимости от сочетания стадий, через которые проходит превращение вещества, сложные реакции могут быть обратимыми, параллельными, последовательными, цепными и т.д. Кроме основного закона важное значение при кинетическом описании таких реакций имеют другие постулаты химической кинетики. Например, для сложных реакций кроме сопряженных действует принцип независимости - в системе каждая стадия протекает независимо от других. По принципу лимитирующей стадии скорость процесса, если он состоит из нескольких последовательных стадий, определяется скоростью стадии, константа скорости которой имеет наименьшее значение.
Определение кинетических параметров сложных реакций является часто очень непростой задачей, для решения которой в химической кинетике используются приемы математического моделирования.