
Главная страница Случайная страница
КАТЕГОРИИ:
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Порядка реакии по экспериментальным данным
|
|
Кинетические расчеты сводятся к установлению порядка реакции и её константы скорости при данной температуре. Методы определения этих кинетических параметров подразделяются на дифференциальные и интегральные в зависимости от того, какая форма, дифференциальная или интегральная, основного кинетического уравнения используется в расчетах.
Дифференциальные методы:
расчетный метод. Используя данные эксперимента, по уравнению (11) рассчитывают средние значения скоростей процесса для нескольких промежутков времени и соответствующие им средние значения концентраций реагирующих веществ. Отношение каждой пары кинетических уравнений позволяет вычислить несколько значений 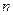 , например,
, например,  или
или 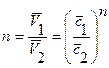 , откуда
, откуда 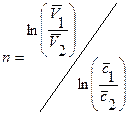 . Окончательно порядок определяется как среднее арифметическое из всех рассчитанных
. Окончательно порядок определяется как среднее арифметическое из всех рассчитанных 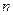 . Зная порядок, по кинетическому уравнению можно рассчитать константу скорости реакции
. Зная порядок, по кинетическому уравнению можно рассчитать константу скорости реакции 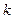 . Сделать это можно столько раз, сколько позволяют экспериментальные данные. Использовать при этом стоит уже усредненный порядок, а несколько величин констант скорости также следует усреднить.
. Сделать это можно столько раз, сколько позволяют экспериментальные данные. Использовать при этом стоит уже усредненный порядок, а несколько величин констант скорости также следует усреднить.
С помощью этого метода можно определять частные порядки по каждому веществу, вступающему в реакцию. Сумма частных порядков определяет порядок реакции в целом.
графический метод. Предполагает логарифмирование основного кинетического уравнения (13) для линеаризации в виде 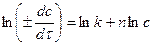 (в этих расчетах можно использовать и десятичную форму логарифма). На рис. 5 показано, что в осях
(в этих расчетах можно использовать и десятичную форму логарифма). На рис. 5 показано, что в осях 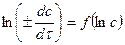 экспериментальные данные располагаются на прямой (при небольшом рассеянии точек, связанном с неизбежными ошибками при получении экспериментальных данных). Тангенс угла наклона этой прямой равен порядку реакции:
экспериментальные данные располагаются на прямой (при небольшом рассеянии точек, связанном с неизбежными ошибками при получении экспериментальных данных). Тангенс угла наклона этой прямой равен порядку реакции: 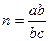 (отрезки
(отрезки  и
и 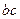 берутся в масштабе соответствующих осей). Отрезок
берутся в масштабе соответствующих осей). Отрезок 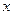 , отсекаемый прямой на ординате при условии
, отсекаемый прямой на ординате при условии 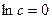 , равен
, равен  , т.е.
, т.е. 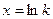 , откуда
, откуда  .
.
 |
Интегральные методы:
расчетный метод или метод подстановки заключается в том, что в интегральные формы кинетического уравнения подставляют данные кинетического эксперимента. При этом находят, какое из уравнений дает постоянную величину константы скорости реакции. Например, при подстановке опытных данных в уравнение первого порядка 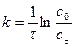 получены следующие значения: 0, 089; 0, 077; 0, 069; 0, 052; 0, 039, а при подстановке в уравнение второго порядка
получены следующие значения: 0, 089; 0, 077; 0, 069; 0, 052; 0, 039, а при подстановке в уравнение второго порядка  получены значения: 0, 0070; 0, 0066; 0, 0068; 0, 0071; 0, 0066; 0, 0067. Первые результаты характеризует монотонное снижение, вторые хорошо усредняются, поэтому рассматриваемая реакция протекает по второму порядку со средней константой
получены значения: 0, 0070; 0, 0066; 0, 0068; 0, 0071; 0, 0066; 0, 0067. Первые результаты характеризует монотонное снижение, вторые хорошо усредняются, поэтому рассматриваемая реакция протекает по второму порядку со средней константой 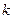 = 0, 0068 (
= 0, 0068 (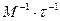 ).
).
графический метод: в табл. 2 представлены виды интегральных уравнений скорости в применении к реакциям нулевого, первого и второго порядков и показана возможность нахождения константы скорости. Линейность графика в соответствующих координатах указывает на порядок реакции, наклон графика, определяемый по тангенсу угла наклона, позволяет найти константу скорости реакции.
Таблица 2