
Главная страница Случайная страница
КАТЕГОРИИ:
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Аллостерическая регуляция активности ферментов
|
|
Аллостерическая регуляция характерна только для особой группы ферментов с четвертичной структурой, имеющих регуляторные центры для связывания аллостерических эффекторов. Отрицательные эффекторы, которые тормо-

|
'зят превращение субстрата в активном центре фермента, выс- лупают в роли аллостерических ингибиторов. Положительные аллостерические эффекторы, напротив, ускоряют ферментативную реакцию, и поэтому их относят к аллостерическим активаторам. Аллостерическими эффекторами ферментов наиболее часто выступают различные метаболиты, а также гормоны, ионы металлов, коферменты. В редких случаях роль аллостерического эффектора ферментов выполняют молекулы субстрата. У таких ферментов, очевидно, по конфигурации активный центр сходен с аллостерическим, - но последний не имеет каталитического участка! 58
(допускается, что у них одинаковы лишь контактные участки), чем и отличается от активного центра фермента. Подобные ферменты имеют как бы собственный самоконтроль за скоростью превращения субстрата.
Некоторые ферменты имеют по несколько аллостерическнх центров; одни нз них специфичны к аллостерическим ингибиторам, другие — к активаторам. Прнчем специфичность связывания активаторов и ингибиторов со своими аллостерическим и центрами может быть разной, как и у активных центров: либо абсолютной, т. е. только к одному эффектору, либо групповой, т. е. к группе сходных по строению эффекторов. Это лишний раз доказывает, что аллостерический центр — это своеобразный активный центр, лишенный каталитического участка. Чем больше аллостернческнх центров н эффекторов, тем чувствительнее реагирует фермент на изменения в обмене веществ.
Механизм действия аллостерических ингибихоров на фермент заключается в изменении конформации активного центра. Снижение скорости ферментативной реакции является либо следствием увеличения Км, либо результатом снижения максимальной скорости cimu при тех же насыщающих концентрациях субстрата, т. е. фермент частично работает вхолостую.
Аллостерические активаторы, напротив, облегчают превращение субстрата в активном центре фермента, что сопровождается или уменьшением Km. или повышением максимальной скорости vma
Аллостерические ферменты отличаются от прочих ферментов особой S-образной кривой зависимости скорости реакции от концентрации субстрата Эта кривая сходна с кривой насыщения гемоглобина кислородом. Она свидетельствует о том, что активные центры субъединиц функционируют не автономно, а кооперативно, т. е. сродство каждого следующего активного центра к субстрату определяется степенью насыщения предыдущих центров Согласованную работу центров обусловливают аллостерические эффекторы Аллостерические ферменты играют важную роль в ормене веществ клетки. Они занимают «ключевое» положение в метаболизме, поскольку тонко реагируют на изменение в обмене веществ и регулируют скорость прохождения веществ по целой системе ферментов. Например, аллостернческая регуляция проявляется в виде ингибирования конечным продуктом первого фермента цепи. Строение конечного продукта после серии превращений ис- -ходного вещества (субстрата) не похоже на субстрат, поэтому конечный продукт, может действовать на начальный фермент цепи только как влдосте- рический ингибитор (эффектор). Внешне такая регуляция сходна с регуляцией по механизму обратной связи и позволяет контролировать выход конечного продукта, в случае накопления которого прекращается работа первого фермента цепи:
А-Ь-в -Ь-с —^-ip
где А, В, С, D — метаболиты; Еь Е3, Еа — ферменты.
Например, аспартат-карбамоилтрансфераза (АКТаза) катализирует первую из шести реакций синтеза цитидинтрифосфата (ЦТФ). ЦТФ—аллостерический ингибитор АКТазьг. Поэтому, когда накапливается ЦТФ, происходит торможение АКТазы и прекращается дальнейший синтез ЦТФ. Обнаружена аллостернческая регуляция ферментов с помощью гормонов. Напри мер, эстрогены - (женские половые гормоны) являются аллостерическим ингибитором фермента глутаматдегидрогеназы, катализирующего дезаминиро- зание глутаминовой кислоты.
11. Множественные молекулярные формы ферментов
Все ферменты, находящиеся в живых организмах, относятся к определенным классам (независимо от источника их получения) в зависимости от типа катализируемых ими реакций. До 1957 г. считалось, что молекулы фермента, катализирующие одну и ту же реакцию, одинаковы. После того как было обнаружено, что для одного и того же фермента возможно-семейство молекул. возник термин «множественные формы ферментов».
Говоря о множественных формах ферментов, имеют в виду ферментные белки, отличающиеся друг от друга по физико-химическим свойствам, но катализирующие одну и ту же химическую реакцию в организме определенного вида.
Природа появления множественных форм ферментов разнообразна и до крица не изучена. В зависимости от причины возникновения их делят на две группы: изоферменты (синонимы — изозимьг, изоэнзнмы) и просто множественные формы ферментов.
Изоферменты — это молекулярные формы ферментов, возникающие «следствие генетических различий в первичной структуре ферментно- ю белка, т. е. физико-химические различия их имеют генетическое пронс хождение. Все негенетически возникшие модификации одного и того же фермента называют множественными формами ферментов (табл. 23).
Функция нзоферментов. Существует мнение, что изоферменты играют регуляторную роль в обмене веществ и позволяют метаболизму в разных
Таблица 23. Множественные формы ферментов
Примеры фериен-го
Генетические:
а) генетически независимые белки
б) гибриды двух и более субъединни, имеющих независимое генетическое происхождение
в) генетические (или алелломорфиые) варианты одного белка, вследствие чего возникают перестановки аминокислот в поли- пептидной цепи, не влияющие на специфическую функцию фермента
Негенетические:
а) белки, сопряженные с другими группами
б) белки, образовавшиеся из одной
тидной цепи (из проферментов)
субъединицы
в) полимеры одной и той ж (разные гомополимеры)
г) кон фор мац ионные формы, разную конформацню одн<
Малатдегидрогеназа митохондрий н цитоплазмы Л а ктатдегидроген аза
Фосфорнлазы А и В Семейство х и мотр и псинов, об разую щихся из химотрнпси-
Глутаматдег и дрогена за {мол. масса 10s и 2, 5. 10s) Все аллоегерические модификации ферментов
тканях лучше приспосабливаться к действию внутренних и внешних факторов. По существу, изоферменты позволяют изменять направление биохимических реакций, так как содержание отдельных изоферментов в разных клетках и тканях и даже в отдельных органоидах внутри клетки неодинаково. Поскольку отдельные изоферменты обладают разным сродством к субстратам и скоростью их превращения, то вариации в наборе индивидуальных молекул изоферментов обеспечивают неодинаковую скорость протекания прямой и обратной реакций. Направление превращений определяет изофермент, преобладающий в данном участке клетки.
12. Полиферментные системы
Каждая клетка организма имеет свой специфический набор ферментов. Некоторые ферменты содержатся во всех клетках, другие присутствуют лишь в немногих. В клетке работа каждого фермента, как правило, не индивидуальна, а. тесно связана с другими ферментами. Так из отдельных ферментов (точнее их множественных форм) формируются полиферментные системы, или конвейеры.
Работа полиферментных систем зависит от особенностей их организации в клетках. Можно условно выделить следующие виды организации полиферментных систем: функциональная, структурно-функциональная и смешанная.
Функциональная организация примечательна тем, что отдельные ферменты объединены в полиферментную".систему, выполняющую определенную функцию, с помощью метаболитов, которые диффундируют от одного фермента к другому. Причем в функционально организованных полиферментных, системах.продукт реакции первого фермента в цепи служит субстратом для следующего и т. д.
Часто метаболит может выполнять роль связки между разными полиферментными системами, если он является общим для индивидуальных ферментов разных полиферментных цепей, каждая нз которых выполняет свои биохимические функции в клетке. Такие «перемычки» нз метаболитов объединяют ферментные системы, даже локализованные в разных органоидах клетки, в единую метаболическую карту клетки.
Примером функциональной организация полиферментных систем служит гликолиз, т. е. распад глюкозы. Все ферменты гликолиза находятся в растворимом состоянии. Каждая реакция катализируется отдельными ферментами. Связующим звеном здесь служат метаболиты. Положение каждого фермента в цепи устанавливается по сродству их к субстратам (начиная с глюкозы), каждый из которых соответственно является продуктом реакции, катализируемой предыдущим ферментом.
Структурно-функциональная организация заключается в том, что ферменты образуют структурные системы с определенной функцией при помощи фермент-ферментных (белок-белковых) взаимодействий. Таким образом формиру- ■ Ътся структурные полиферментные надмолекулярные комплексы. К ним относятся, например, полиферментный комплекс пируватдегилпогеназа, состоящий лз нескольких ферментов, участвующих в окислении пировиноградной кислоты, или синтетаза жирных кислот, состоящая из семи структурно связанных ферментов, в целом выполняющих общую функцию — синтез жирных кислот-
в—271
Такие полиферментные комплексы очень прочны'и с трудом распадаются на отдельные ферменты. Этим они отличаются от полиферментных систем с функциональной организацией.
Кроме полиферментных комплексов возможен и другой вариант структурно-функциональной организации. Так, ферменты могут закрепляться на биологической мембране и выстраиваться в цепи. Таким образом, например, устроена дыхательная цепь митохондрий, участвующая в транспорте электронов и протонов и образования энергии.
Очевидно структурно-функциональный тип организации важен для тех ферментных систем, биологические функции которых должны выполняться с большой степенью стабильности. Разделение ферментов в таких системах прекращает их деятельность.
Смешанный тип организации полиферментных систем представляет собой комбинацию обоих типов организации, т. е. часть полиферментной системы имеет структурную организацию, часть—функциональную. Примером такой организации служит пол и ферментная система цикла Кребса, где часть ферментов объединена в структурный комплекс (2-оксоглутаратдегидрогеназный комплекс), а часть соединена друг, с другом функционально с помощью связующих метаболитов.
13. Иммобилизованные ферменты
Иммобилизованные, или нерастворимые, ферменты — это искусственно полученный комплекс фермента с нерастворимым в воде носителем. Иммобилизация (от лат. immobilis — «неподвижный») осуществляется: путем физической адсорбции фермента на нерастворимом материале; включением фермента в ячейки геля; а также ковалентным связыванием фермента с нерастворимым материалов или молекул фермента между собой с образованием нерастворимых полиферментных комплексов.
S качестве адсорбентов используют стекло, силикагель, гндроксилапа- ткт, " целлюлозу и ее производные. Для включения фермента в ячейки геля используют разнообразный гелеобразующнй материал, чаще всего полиакрила мидный гель. В качестве материала для ковалентиого связывания ферментов применяют полипептиды, производные стирола, полиакриламид, нейлон, различные производные целлюлозы, крахмал, агарозу, а также стекло, силикагель и т. д. При ковалентном связывании ферменты находятся на химическом «поводке» у нерастворимого носителя.
При получении иммобилизованных ферментов принимают все меры предосторожности для сохранения активности фермента. Иммобилизованные ферменты обычно менее активны, чем исходные, поскольку связывание с носителем ослабляет контакт с субстратом.
Иммобилизованные ферменты являются как бы моделью структурно- организованных в клетке ферментов (мембрана — это та же нерастворимая основа для соединения с ферментом), поэтому они служат для изучения свойств ферментов, связанных с внутриклеточными структурами. Помимо этого, иммобилизованные ферменты имеют большое преимущество перед обычными ферментами. Нерастворимые ферменты легко удаляются из реакционной среды, их можно промывать от продуктов реакции и вновь использовать. 162
14. Практическое значение ферментов
Ферменты широко применяются а практической деятельности человека. Они используются в различных областях народного хозяйства, не говоря уже об исключительном значении для медицинской практики. Препараты амилазы (получаемые из плесневых грибов) облегчают гидролиз крахмала и тем самым улучшают созревание теста при выпечке высших сортов хдебо-булочных изделий и спиртовое брожение при получении пива. Другой фермент — пектнназа, гидролизующий пектиновые вещества оболочек растительных клеток, увеличивает выход сока из плодово-ягодной продукции и облегчает извлечение из растительного сырья ценных эфирных масел, используемых в парфюмерии.
Обработка яротеолнтическими ферментами мяса повышает скорость его созревания, оно становится мягким, нежным и вкусным. В-кожевенном производстве те же протеолнтическое ферменты применяют для обработки шкур н мягчения кожевенного сырья.
Специфические свойства фермента глюкозооксидазы, катализирующего прямое окисление глюкозы кислородом воздуха, применяются в пищевой промышленности для удаления глюкозы из продуктов, подлежащих длительному хранению, и кислорода из консервных банок и бутылок с напитками, что предохраняет продукты от порчи. Ферментные добавки (протеолитические ферменты) применяют в производстве специальных стиральных порошков, которые снимают «белковые пятна» на одежде.
В сельском хозяйстве ферменты применяют как добавки при силосовании кормов, что повышает доступность биологических веществ и улучшает питательную ценность корма. С помощью бактериальных ферментов получают из нефтяных продуктов кормовой белок для животноводства.
В медицине ферменты имеют диагностическое значение — определение отдельных ферментов в клинике помогает распознаванию природы заболевания. Их используют для замещения недостающего фермента в организме или для разложения какого-либо субстрата, с избыточным содержанием которого связывают признаки заболевания. Наиболее часто в клинике применяют пищеварительные ферменты (пепсин, трипсин и т. д.).
С помощью иммобилизованных ферментов осуществляется промышленный синтез ряда гормональных препаратов на фармацевтических предприятиях, разработаны высокочувствительные методы анализа лекарств, экспресс- анализ биологических компонентов и многое другое. Протеолитические ферменты (трипсин, химотряпсин), иммобилизованные на марлевых салфетках, тампонах, применяют в хирургической практике для очищения гнойных ран, омертвевших тканей, основанного на ферментативном разложении белков погибших клеток в гнойных ранах. Иммобилизованные и растворимые ферменты становится одним из самых распространенных лекарств биологического^ происхождения.
ГЛАВА 11. ТРАНСПОРТ ВЕЩЕСТВ В ОРГАНИЗМЕ
Транспорт, или перемещение веществ из одного участка в другой, — необхо димое звено не только обмена веществ, но и вообще процессов жизнедеятельности организма. Чаще всего транспорт играет связующую роль, на пример, восполняя «разрыв» между различными участками метаболизма внутри клеток или разными тканями и органами.
Благодаря транспорту возможна биохимическая специализация органов и тканей организма, что экономит энергетические и пластические ресурсы для синтеза всего набора ферментов в каждой ткани и органе. Например, жировая ткань специализирована на образовании триацилглицеринов из различных субстратов и освобождает прочие ткани от необходимости синтезировать их в больших количествах. По мере надобности происходит мобилизация липидов в жировой ткани и снабжение ими других тканей и органов. Таких примеров координации обмена веществ в организме много.
Транспорт веществ возможен с помощью следующих механизмов.
I Механический транспорт: а) без носителя; б) с носителем.
2. Диффузионный транспорт: а) обычная диффузия (пассивный транспорт); б) облегченная диффузия (облегченный транспорт).
3. Активный транспорт: а) первичный активный транспорт; б) вторичный активный транспорт.
4. Электрофоретический транспорт.
5. Везикулярный транспорт (цитоз): а) пиноцитоз (эндоцитоз); б) экзо- цитоз.
Механизмы транспорта отличаются друг от друга природой сил, заставляющих перемещаться вещества из одного участка в другой, й некоторыми другими особенностями.
1. Механический транспорт
Механический транспорт веществ происходит в результате движения (циркуляции) жидкости или гидростатического давления, создаваемого механической работой сердца и других органов. Механический транспорт имеет место при переносе веществ с кровью и лимфой и присущ любым веществам (природным и чужеродным), которые в данный момент находятся в этих циркулирующих жидкостях. Можно выделить две разновидности механического транспорта: с носителем и без носителя. В первом случае переносимое вещество растворено в водной среде, т. е. является гидрофильным, а во втором — связывается с носителем (с белками или даже с клетками крови). Как правило, во втором случае транспортируются неполярные вещества, которые при отсутствии или недостатке носителя могут «оседать» на эндотелии сосудов.
2. Диффузионный транспорт
Диффузионный транспорт происходит под действием осмотических сил, т. е, связан с градиентом концентрации данного вещества. В бесструктурной среде (например, во внутри- и внеклеточной жидкости)' временный градиент концентрации веществ может наблюдаться, например, вследствие проникновения их из других «отсеков» в данный участок или в результате образования их с помощью находящегося в этом участке фермента. С помощью диффузии происходит перемещение веществ нз зоны производства в зону потреб ления. В структурно организованной среде — мембране — диффузия возникает из-за разницы концентрации веществ по обе стороны мембраны, например •
| яя |
| I 1 I |
" ' шш
T ранило of на»" J
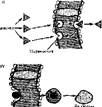
|
Рис. 29. Схема транспорта веществ через мембрану. I — простая диффузия; II — облегченная диффузия; 111 — активный транспорт: а — первичный активный транспорт, б — вторичный активный транспорт; IV— эадоиитоэ (пииоцнтоз); V — экзо-
между внутри- и внеклеточной средой на плазматической мембране или между внутри- и внемитохондризльной средой на митохондриальной мембране и т. д. Диффузия бывает двух типов (рис. 29) — обычная (пассивный транспорт) и облегченная (облегченный транспорт).
Обычная диффузия, или диффузия без переносчика (рис. 29, /), определяется градиентом концентрации и растворимостью транспортируемых веществ в среде или веществе мембран (особенно его липидного слоя). Путем обычной днффузни перемещаются в бесструктурной среде (клеточном соке, межклеточной жидкости) все водорастворимые молекулы, если возникает избыток вещества на одном из участков. Через мембрану путем простой диффузии проникают малые биомолекулы — вода, С02, 02, а также некоторые ионы, глюкоза и, возможно, другие вещества. Чужеродные вещества, проникающие в организм, могут проникать через мембрану путем пассивного транспорта внутрь клетки, если они липофильны.

|
Облегченная диффузия (рис. 29, II) отличается от обычной только тем, что происходит с подвижным переносчиком, облегчающим прохождение ее-. щества по градиенту концентрации. Возможна внемембранная и мембран- • ная облегченная диффузия вещества. При внемембраннфй диффузии вещество связывается со специфическим носителем в биологических жидкостях (внутри-
и межклеточной среде). В качестве переносчиков чаще всего выступают белки, например белки-рецепторы, связывающие гормоны, витамины и т. д. внутри клетки. Для облегченной мембранной диффузии требуется переносчик, находящийся в мембране. В зависимости от направления-переноса вещества облегченная диффузия может быть латеральной (если белок, связывающий вещество, движется вдоль мембраны) и поперечной (если белок движется сквозь мембрану).
В отличие от обычной диффузии при облегченной диффузии имеется предел скорости транспорта, поскольку он зависит не столько от разницы концентрации вещества по обе стороны мембраны, сколько от количества молекул-переносчиков. Поэтому зависимость скорости транспорта вещества от его концентрации графически напоминает кривую Михаэлиса. Она имеет зону насыщения, что отличает облегченный транспорт от пассивного (в последнем случае насыщения не бывает н по мере увеличения концентрации вещества скорость переноса постоянно возрастает). Транспорт путем облегченной диффузии используется для переноса органических кислот, моносахаридов, жирорастворимых витаминов, стероидных гормонов и т. д. Очевидно, чужеродные, для организма вещества полярной природы также проникают путем облегченной диффузии, связываясь с подходящими переносчиками, хотя последние на несколько порядков менее специфичны для чужеродных соединений, чем для природных.
3. Активный транспорт
При активном транспорте (рис. 29, Ш) перенос веществ происходит против градиента концентрации, т. е. из зоны низкой концентрации вещества в зону его высокой концентрации. Такой транспорт обязательно требует затрат энергии, поскольку переносить вещество приходится против действия осмотических (концентрационных) сил. Источником энергии активного транспорта служит АТФ или электрохимический потенциал некоторых ионов (например, ионов водорода, натрия). Активный транспорт (в отличие от механического и диффузионного) является ферментативным процессом. Он осуществляется специальными ферментными транспортными системами, способными использовать химическую энергию АТФ или энергию электрохимического потенциала для транспорта веществ. Другая особенность активного транспорта состоит в том, что он возможен только в организованных структурах —- бномем- бранах, через которые не могут свободно диффундировать вещества по градиенту концентрации. Поэтому мембраны поддерживают градиент, создаваемый ферментной системой активного транспорта.
В зависимости от использования источника энергии активный транспорт может быть первичным и вторичным. В первичном (рис. 29, III, о) на транспорт данного вещества против его градиента концентрации по обе стороны мембраны затрачивается энергия АТФ. Во вторичном используется электрохимический градиент на мембране какого-либо вещества (например, ионов натрия и водорода), на создание которого была затрачена АТФ, т. е. энергия АТФ расходуется на транспорт косвенно, через градиент другого вещества Созданный электрохимический градиент того же натрия используется для транспорта другого веществу, например глюкозы. При вторичном активном транспорте одно вещество (А) как бы создает условия для прохожде- 166 ния другого вещества (В) (рис. 29, ///, 6). Причем направление перемещения через мембрану двух веществ или совпадает, или не совпадает. Если вещества переносятся в одном направлении, например, Na+ и глюкоза, то такой совместный транспорт называется симпорт. Если вещества пересекают мембрану в противоположных направлениях, то такой транспорт называется ■ антипорт.
Путем первичного активного транспорта переносятся ноны натрия, калия, кальция, магния (возможно, и другие) через клеточную мембрану, а ионы водорода — через митохондриальную мембрану. Транспортными системами для них служат специальные ферменты аденозинтрифосфатазы (АТФазы), которые локализованы в толще мембпян Они гидролизуют ЛТФ на АДФ и неорганический фосфат и используют энергию фосфатных связей на перенос ионов через мембрану. Для каждых ионов имеется' своя специфическая АТФаза, которая ими активируется. Так обнаружены Na+, K+-АТФаза, Са2+-АТФаза, Л^г+-АТФаза, Н+-АТФаза, которые создают градиент концентрации соответствующих ионов между двумя сторонами мембраны. При этом расходуется АТФ, т. е. фактически химическая форма энергии АТФ трансформируется в осмотическую энергию (выражающуюся в разнице концентраций ионов на мембране) и электрическую, если на одной из ее сторон создается избыток электрических зарядов.
Возможен ли обратный процесс, осуществляемый АТФазами? Считается, что действие АТФаз обратимо. Поэтому энергия, накопленная в виде электрохимического градиента ионов на мембране, может, в принципе, использоваться на синтез АТФ из АДФ и НзРО*, если ионы будут, перемещаться по градиенту их концентрации.
Na+, K+-АТФаза имеется во всех клетках организмов животного и растительного мира, в бактериях. Это говорит об универсальной общебиологической функции ее как транспортной системы. В организме человека наиболее высока активность ее в нервной ткани, в почках и секреторных органах, т. е. там, где наиболее выражены процессы активного транспорта веществ. •Na+, К+-АТФаза локализована главным образом в клеточной мембране (хотя обнаруживается этот фермент и в мембранах эндоплазм этического ретикулу- ма, ядерной мембране). Она обеспечивает первичный активный транспорт ионов Na+ н К* через клеточные (и, возможно, другие) мембраны. Nat, К+- АТфаза находится в толще мембраны (рис. 30). Такое расположение фермента позволяет асимметрически связываться с ним ионам Na+ и К+, находящимся по обе стороны клеточной мембраны. Для Na+, К+-АТФазы необходимы ионы MgJ+, которые помогают связываться АТФ с активным центром фермента, обращенным внутрь клетки. Фактически субстратом фермента служит комплекс Mg^-АТФ. Присоединение Мд2+-АТФ к активному центру фермента изменяет его сродство к ионам натрия и калия. Для проявления активности Na+, К+-АТФазы, т. е. для гидролиза АТФ, необходимо связывание иона Na+ на внутренней поверхности мембраны (внутри клетки) с так называемым натриевым участком фермента, а иона К+—-на внешней поверхности (вне клетки) с калиевым участком. Это вызывает активный транспорт ионов в противоположных направлениях за счет гидролиза АТФ. При этом в ходе гидролиза АТФ образуется промежуточный продукт— фосфорилированный. фермент.
.Под действием Na+. К+-АТФазы ионы натрия постоянно откачиваются
из клетки (поэтому Na+, К+-АТФа- зу часто называют натриевым насосом), а ионы калия поступают из внеклеточной среды внутрь клетки, т. е. наблюдается антипорт этих 2К+ ионов. Для проявления максимальной активности Na+, К+-АТФазы концентрация ионов Na+ должна быть около 100 ммоль/л, а калия — 3Na+ 20 ммоль/л. Причем нон Na+ является обязательным для работы Na+, К+-АТФаэы, а ион К+ может быть заменен другими одновалентными катионами — аммония, рубидия, цезия, лития и даже таллия.
При гидролизе одной молекулы АТФ Na+. К -АТФаза вызывает перенос трех ионов Na+ из клетки и двух ионов К+ в клетку (см. рис. 30). Неравнозначный перенос (по у'заряженных частиц через мембрану вызывает поляризацию мембраны — появление положительного заряда на внешней и отрицательного на внутренней ее сторонах. Поэтому натриевый насос называют электрогенным. Градиент Na+, создаваемый на мембране работой Na+, К+-АТФазы, используется для вторичного активного транспорта различных веществ, например глюкозы, аминокислот. Он играет роль своеобразной энергетической «пружины», с помощью, которой обеспечивается переход других веществ (аминокислот, глюкозы) против градиента их концентрации.
Все природные вещества, лекарства и яды, изменяющие активность Na+, К+-АТФазы, влияют на натрий-калиевый градиент на мембране, ее электрический заряд (а следовательно, и на функцию возбудимых тканей) и транспорт веществ через мембрану с помощью электрохимического градиента ионов Na+. Среди регуляторов Na+, К+-АТФазы имеются ингибиторы и активаторы. Ее природным регулятором являются ноны кальция. Внешний Са2+ активирует связывание внешнего К+ специфическим участком фермента н включает работу Na+, К+-АТФазы по транспорту ионов. Избыток внутриклеточного' Са2+, напрртив, блокирует Na+, К+-АТФазу, и только устранение высоких концентраций внутриклеточного Са2+ другими системами позволяет включить Ыа+/К+-насос.

| мембрана |
| , К^-АТФаа Р-) |
Классическими ингибиторами фермента являются уабаин (строфантин G) и другие препараты сердечных гликозидов, широко использующиеся в медицинской практике как стимуляторы сердечных сокращений. Торможение сердечными гликозидами фермента вызывает выравнивание натриевого градиента на мембране, ее деполяризацию и угнетение вторичного активного транспорта веществ через мембрану. Гликозиды ингибируют Na+, К+-АТФазу, связываясь с участком фермента, обращенным на внешнюю сторону клеточной мембраны, т. е. конкурируют за места связывания с ионами К+. Если гли-
козндами подействовать на фермент с внутренней стороны, то они никакого влияния на функцию Na+/K+-Hacoca не оказывают. Поэтому действие сердечных гликозндов можно снять избытком ионов К+, что используется в медицинской практике, когда нагружают организм растворами солей калия при отравлении гликозидами.
Ингибиторами фермента являются также тетраэтиламионий, ионы меди, железа, некоторые гормоны (эстрогены, глюкагон, адреналин). Активируют Na+, К+-АТФазу многие природные аминокислоты, дипептиды (карнозин и ансерин). Увеличивают количество этого фермента в почках кортикостеронды (особенно альдостерон).
Са2+-АТФаза. Другой фермент активного транспорта — Са2+-АТФаза — использует энергию гидролиза АТФ для переноса против градиента ионов кальция. Этот фермент находится как в клеточной, так и во внутриклеточных мембранах — эндоплазматического ретикулума, митохондрий. Высокая активность Са2+-АТФазы, или кальциевого насоса, отмечается в мышечной ткани, особенно в саркоплазматическом ретикулуме, в нервной ткани, почках, т. е. там, где процессы активного транспорта определяет функцию органов и тканей. Са2+-АТФаза откачивает ноны Са2+ за счет энергии АТФ в обмен на ионы Na" 1" или Mg2+, т. е. происходит антипорт этих катионов. Причем количество обмениваемых катионов одинаково. Поэтому кальциевый насос в отличие от натриевого является электронебтральным. За счет градиента ионов кальция на мембране возможен вторичный активный транспорт других веществ.
Са2+-АТФаза мембран митохондрий обменивает ионы Са2+ на ионы Н+, причем Са2+ поступает внутрь митохондрий, а протоны — наружу.
С помощью кальциевых насосов эндоплазматического ретикулума и митохондрий регулируется внутриклеточное содержание Cai+, а с ним активность многих ферментов, чувствительных к этому нону.
М^+-АТФаза — малоизученная транспортная система, находящаяся во внутриклеточной и плазматических мембранах. Активность этого фермента относительно низка. Эта транспортная система обеспечивает антипорт ионов Mg2+ на два, иона Na+ или Н+ при гидролизе одной молекулы АТФ, 'т. е. транспорт электронейтрален.
Н+-АТФаза участвует в преобразовании энергии во внутренних мембранах митохондрий и тилактоидов хлоропластов (подробно ее функции- излагаются в разделе «Биоэнергетика»), Градиент ионов Н+ на мембранах упомянутых органоидов используется для вторичного активного транспорта, например органических кислот через мембрану.
4. Электрофоретическнй транспорт
Электрофоретический транспорт — это транспорт заряженных частиц в электрическом поле. Движущей силой транспорта служат знак заряда и значение электрического потенциала, например, на мембране. Поскольку все мембраны поляризованы и имеют тот или иной электрический потенциал, то возможно перемещение веществ из одного внутриклеточного пространства в другое или между вне- и внутриклеточной средой путем электрофореза. Таким способом транспортируются, например, органические кислоты, возможно, минеральные вещества и нуклеотиды.
5. Везикулярный транспорт (цитоз)
Везикулярный транспорт обеспечивает перенос крупных молекул и частиц (белки, обломки мембраны, чужеродные тела) через клеточную мембрану. В ходе транспорта образуются везикулы, или пузырьки, состоящие из переносимых молекул вещества, окруженных участком клеточной мембраны. Различают два вида цитоза — пиноцитоз (эндоцитоз), когда вещества втягиваются из внешней среды внутрь клетки (т. е. поглощаются из внешней среды), и экзоцитоз, когда макромолекулы поступают из клетки во внешнюю среду. Пиноцитоз особенно выражен у лейкоцитов, гистиоцитов, клеток так называемой ретнкулоэндотелиальной системы, находящихся в костном мозге, селезенке, печени и т. д. Способность к пиноцитзу, выраженная в разной степени, наблюдается у всех клеток организма. Механизм пиноцитоза во многом неясен. При контакте крупных молекул или частиц с внешней поверхностью клеточной мембраны ее участок становится податливее, и вещество как бы утопает, втягивается внутрь клетки вместе с этим участком мембраны. Предполагают, что в мембране находится особый гликопротенд (кластрии), который помогает втягивать внутрь клетки участок мембраны, контактирую- • щий с поглощаемой частицей. Считают, что для этого процесса используется энергия АТФ.
Поступающие в клетку вещества, как правило, сливаются с лизосомами, где подвергаются действию их гидролитических ферментов. Чужеродный материал, даже бактерии, поглощенные клетками, могут уничтожаться таким способом.
Экзоцитоз типичен для клеток, способных к секреции крупных молекул, например белков. Этот механизм транспорта особенно активен в железистых клетках, секретирующих макромолекулы в окружающую среду. Участвуют в этом процессе компоненты аппарата Гольджи.
6. Локализация переноса веществ в организме
В зависимости от локализации переноса веществ в организме можно условно выделить следующие его разновидности (для каждой из них используются свои механизмы транспорта): 1) межорганный (межтканевой); 2) транскапиллярный; 3) трансцеллюлярный; 4) внутриклеточный; 5) межмолекулярный.
Межорганный (межтканевой) перенос — вещества транспортир уютсй (распределяются) между органами или тканями. Перенос осуществляется механическим способом с кровью и лимфой, т. е. гематогенным и лимфоген- ным путем. Масса переносимого в единицу времени вещества зависит от растворимости его в крови и лимфе (если для растворения необходим носитель, то от количества связующих мест носителя) и скорости движения жидкости. Скорость движения крови определяется прежде всего сократительной деятельностью сердца и рядом других факторов. Значит, массо- перенос любого вещества между органами зависит от его концентрации в крови (лимфе) и скорости кровотока (лимфотока). Снижение растворимости веществ (вследствие любых причин) 170 и снижение кровотока из-зга слабости сердечной деятельности или иных причин уменьшает эффективность межорганного транспорта веществ.,
Транскапиллярный транспорт. В капиллярах (кровеносных и лимфатических) происходит обмен между химическими компонентами крови и межклеточной жидкостью, а следовательно, клетками тканей. Поскольку функция капилляров состоит в снабжении клеток органов и тканей необходимыми для жизнедеятельности веществами (энергетическими, структурными, минеральными, кислородом и др.) и в удалении продуктов метаболиза, то количество капилляров в тканях с интенсивным окислительным обменом (например, в сердце) выше, чем в тканях с более низким обменом (например, в скелетных мышцах). Капилляры состоят из одного слоя клеток эндотелия, скрепленных гликопротеидами, и базальной мембраны, образующей «подстилку» для эндо- телиальных клеток. Базальяая мембрана построена из мукополисахаридов (главным образом гиалуроновой кислоты) и двух типов белков — коллагена и глнкопротеида, переплетенных между собой в виде решетки.
' " Строение капилляров позволяет проникать веществам через так называемые' «поры» между эндотелиальными клетками, размер которых колеблется в разных типах капилляров от 4 до 200 нм, и непосредственно сквозь эндотелий (трансэндотелиальный перенос)..Через капилляры проходят как крупные молекулы типа белков (и даже клетки крови, включая самые крупные эритроциты), так и более мелкие: вода, соли, органические кислоты, моносахариды и т. д.
, В основе транскапиллярного обмена лежат различные механизмы транспорта. Движение жидкости, а с ней и растворенных веществ -через капиллярную стенку возникает за счет разницы гидростатического давления между кровью и межклеточной жидкостью, а также разницы осмотического давления между ними. Вещества движутся через поры между эндотелиальными клетками, рыхло сцепленными гликопротеидами, и через полисахаридную решетку базальной мембраны по градиенту гидростатического осмотического давления. Транспорт веществ через капилляр напоминает ультра фильтрацию. Значение фильтрационного, давления можно вычислить и. предсказать направление перемещения веществ между кровью и межклеточной жидкостью. В артериальном конце капилляра гидростатическое давление равно 3, 990 кПа, в венозном — 1, 995, в межклеточной жидкости — 1, 064 кПа. Разница гидростатического давления в артериальном отрезке капилляра составляет 2, 926 кПа, а в венозном — 0^931 кПа. Осмотическое давление плазмы крови, обусловленное концентрацией белков (онкотическое давление) и различных солей, равно 3, 325 кПа, а тканевой жидкости — около 1, 330 кПа. Разница его составляет в обоих концах капилляра 1, 995 кПа. Высокое осмотическое давление крови противостоит гидростатическому давлению и способствует поступлению воды и растворенных веществ из межклеточной жидкости. Фильтрационное давление, составляющее разницу между гидростатическим и осмотическим, имеет в артериальном отрезке капилляра положительное значение 0, 931 кПа, а в венозном отрицательное —1, 064 кПа. Это благоприятствует фильтрации веществ (механический транспорт) в артериальном отрезке капилляра и всасыванию их в венозном. Всякие изменения гидростатического и осмотического давлений сказываются на транспорте веществ через'капилляр.
Кроме механического транспорта через капиллярную стенку происходит обмен с помощью диффузии, везикулярного транспорта, активного транспорта. Если.диффузия веществ между кровью и межклеточной жидкостью возможна как через поры между клетками эндотелия, так и через клетки, то остальные механизмы транспорта возможны только при непосредственном участии эндотелиальных клеток. Интересно, что везикулярный транспорт (или, как его называют, микровезикулярный) веществ происходит сквозь клетки эндотелия из крови в межклеточную жидкость.
Межклеточный транспорт имеет место в межклеточной среде. Вследствие постоянного гидростатического давления в этом участке организма транспорт веществ между клетками возможен путем диффузии или электрофореза, поскольку внешня-я поверхность клеток отрицательно заряжена по отношению к окружающей среде.
Трансцеллюлярный транспорт — перенос веществ сквозь клеточную мембрану любых клеток. Необходим для обмена между клеточной и внутриклеточной средой. Транспорт веществ осуществляется с помощью диффузии (простой и облегченной), электрофореза, активного транспорта (первичного и вторичного), везикулярного транспорта.
Внутриклеточный перенос — имеет место при транспорте веществ между различными органоидами и пространствами внутри клетки. Механизмы транспорта те же, что для трансцеллюлярного.
Межмолекулярный перенос заключается в транспорте веществ между активными центрами соседних макромолекул ферментов, входящих в состав надмолекулярного комплекса или полиферментной цепи.