
Главная страница Случайная страница
КАТЕГОРИИ:
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Глава 12. Биохимия питания и пищеварения 3 страница
|
|
Значения редокс-потенциалов позволяют предсказать направление потока электронов при биологическом окислении и рассчитать изменение энергии при переносе электронов от одной редокс-пары к другой.
Субстраты окисления, как уже указывалось, образуются в ходе катаболизма белков, углеводов и липидов. Эти субстраты подвергаются дегидрированию как наиболее распространенному типу биологического окисления, происходящего с участием находящихся в клетке дегидрогеназ. Если акцепто- 192
ром водорода в реакциях дегидрирования служит не кислород, а другой субстрат, то такие реакции называют анаэробным окислением-; ъели же акцептором водорода является кислород н образуется вода, то такие реакции биологического окисления называют тканевым дыханием.
Анаэробное окисление есть не что иное, как процесс генерации водорода (второй блок в приведенной выше схеме энергетического аппарата клетки) В этих реакциях участвуют никотинамидэависимые дегидрогеназы, где акцептором отщепляемого от органического субстрата водорода служат НАД+ и НАДФ+, и флавинзависимые дегидрогеназы, где акцептором водорода служат ФМН и ФАД. Субстраты дегидрирования образуются вне митохондрий, но затем транспортируются внутрь митохондрий, где совершаются окислительные превращения веществ.
ГЛАВА 13. АЭРОБНОЕ ОБРАЗОВАНИЕ ЭНЕРГИИ
В МИТОХОНДРИЯХ
В митохондриях производится основная часть всей энергии клетки, поэтому митохондрии образно называют энергетическими станциями клеток.
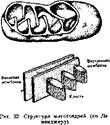
1. Структурная организация мятохоядрий
Митохондрии находятся в животных и растительных клетках. Их форма варьирует от овальной до палочковидной и нитевидной. Недавно было доказано, что митохондрии, тесно примыкая друг к другу, располагаются в ряд, имея вид митохондриальных сетей, а не рассеянных по клетке изолированных органоидов, как представлялось ранее.
|
Митохондрии имеют размеры порядка 0, 5x3, 0 им. Они состоят нз двух отдельных мембранных мешков: наружного и внутреннего, которые разделены мембранным пространством, заполненным водной средой (рнс. 32). Наружная мембрана состоит наполовину из белков и липидов. Внутренняя мембрана примерно на 3Д состоит из белков и на '/4 из.ципндов, в основном кардиолипи- на. Внутренняя мембрана причудливо укладывается, образуя складки — кристы. Пространство между, кристами заполнено водной фазой — матриксом. Внутренняя поверхность крист, обращенная к матрик- су, усеяна грибовидными частицами, называемыми элементарными частицами. При обработке митохондрий в гипотонической среде (например, в дистиллированной воде) наружная мембрана лопается и остается внутренний мембранный мешок. Внутренняя мембрана прочна и не поддается разрушению с помощью осмотического шока. Необходима специальная
7—271
химическая обработка детергентами (тритоном Х-100, твином, дигитонином н другими), которые разрушают внутреннюю мембрану. Можно разрушить мембрану ультразвуком. При этом фрагменты внутренней мембраны замыкаются и образуются так называемые субмитохондриальные частицы, которые представляют собой как бы вывернутый наизнанку участок внутренней мембраны митохондрий.
Операции по выделению основных структур митохондрий позволили выяснить локализацию в них отдельных фермектов и целых биохимических Циклов.
2. Ферментные системы митохондрий— генераторы водорода
ется как промежуточный продукт распада углеводов, белков и аминокислот, глицерина. Окислению пируват подвергается в митохондриях, куда он проникает из цитоплазмы. Кроме пиру(вата в митохондриях окисляются й другие субстрату. Некоторые из них участвуют в акцептировании водорода цитоплазмы и переносе его внутрь митохондрий к дыхательной цепи. Ценность пирувата как субстрата окисления состоит не только в том, что он является источником водорода, но и ацетил-КоА, который можно отнести к основным продуцентам водорода в митохондриях Остановимся прежде на ферментативной системе окисления пирувата.
Окисление пирувата до ацетнл-КоА
Окислительное декарбоксилирование пировиноградной кцслоты осуществляется полиферментным пирцватдегидрогеназным комплексом. Этот комплекс находится в матриксе, но не в растворенном виде, а прикрепляется к белкам внутренней мембраны митохондрий, обращенным в матрйкс. Пируватдегидро- геназный комплекс является примером структурной организации нескольких разных ферментов и обладает всеми преимуществами такой организации.
Масса пвруаатдегидрогеназного комплекса 4 • 10 дальтон. Он состоит из трех разных ферментов: пируватдегидро- гвназы, дигйдролипоцлацетилтрансфера- зы и дигидролипоилдегидрогеназы. На рис. 33 пируватдегидрогеназа изображена в виде внешних больших сфер, ди- гидролипонлацетилтрансфераза, — в центре, в виде мелких сфер, а дигидро- липоилдегидрогеназа ' занимает среднюю часть комплекса и изображена в виде четырех групп сфер среднего размера.
 Рнс. 33. Структура пируватдегидрогенаэ-
ного полифсрмситксго комплекса: / — пируватдегидрогеназа; 2 — дигидролипо- кданетнлтрансфераза; 3 — дигидролипоклде- гидрогеназа
Рнс. 33. Структура пируватдегидрогенаэ-
ного полифсрмситксго комплекса: / — пируватдегидрогеназа; 2 — дигидролипо- кданетнлтрансфераза; 3 — дигидролипоклде- гидрогеназа
|
Пнруватд^гидрргеуаза состоит из 24 молекул фермента, каждая из которых содержит одцн остаток тиа- мцндуфосфата, являющегося коферментом п нру в атдегидроген аэ£ 4. Общая масса этого фермента примерно 2, 16 • Ю®
дальтон. Дигидролипоилацетилтрансфераза имеет массу порядка 0, 76 • 10® дальтон; четвертичная структура этого фермента состоит из 24 субъединиц с молекулярной массой 36 000. Каждая субъеднница дигид- ролипоилацетилтрансферазы содержит один остаток лнпоевой кислоты. - В состав комплекса входит 12 молекул дигидролнпоилдегидрогенаэы, каждая из которых содержит 1 остаток ФАД. Общая масса этого ферментного комплекса 0, 66 • 10е дальтон.
Итак, все ферменты пируватдегидрогеназного комплекса двухкомпо- нентны и содержат прочно связанные коферменты: тиаминпирофосфат (ТПФ), липоевую кислоту (ЛК С |) и ФАД. Кроме того, в работе комплекса, т. е. в окислении пирувата, принимают участие два внешних (не связанных с комплексом) кофермента: KoA-SH и НАД+, которые играют роль акцепторов продуктов окисления пирувата. ПнруЬат последовательно подвергается действию ферментов пируватдегидрогеназного комплекса.
Обозначив ферменты комплекса: Е, -ТПФ — пируватдегидрогеназа, Е^ЛК5^! —дигидролипоилацетилтрансфераза, Е3-ФАД — дигидролипоилде- гидрогеназа, можно записать стадии окисления пирувата следующим образом.
н
1) Е.-ТПФ + СН, —С—СООН — Е, -ТПФ—СН, + СО*
«1 о йн
н
2) Е, -ТПФ—С—CHs-t-Ej-ЛК^! -»Е, -ЛКС ' +Е, -ТПФ Xs ь—С—СНг
Ь
4) Е»-ЛК< + Е, -ФАД —Е, -ФАД-Н, + Е}-ЛК< |
SH s
5) Е9-ФАД. Hs + НАД* -v Е„-ФАД + НАД. H + Н*
На первой стадии действует пируватдегидрогеназа, в результате образуется конечный продукт обмена СОа (декарбоксилирование пирувата) и гидро- оксиэтнльное производное, связанное с ТПФ в активном центре пируват- дегидрогеназы. Другой фермент — дигидролипоилацетилтрансфераза катализирует две стадия: это восстановление дисульфидной группы липоевой кислоты за счет гндроксиэтнла и перенос ацетильной группы на внешний KoA-SH (стадии 2 и 3). В результате образуется восстановленная форма фермента — дигндролипоил-Е2 и конечный продукт окисления пирувата в
пируватдегидрогеназном комплексе — ацетил-КоА. Третий фермент -комплекса — дигидролипоилдегидрогеиаза окисляет восстановленную форму липоевой кислоты (4 стадия), акцептируя водород собственным кофермен- том — ФАД. Затем он катализирует реакцию дегидрирования и перенос водорода на внешний НАД+. В результате образуется конечный продукт окисления НАД • H + H*.
В общем виде уравнение окисления пирувата ферментами пируватдегидрогеназного комплекса выглядит так:
СН, —С—СООН--------- n.Hmiw.pwHwi «0-Ц..КС- vCHa_ с~SKoA + СО, + НАД. H + Н+
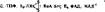
|
| о |
| о |
Этот процесс сопровождается значительным уменьшением стандартной свободной энергии (Д<? =—8, 0 кДж/моль), что говорит о необратимости его в физиологических условиях. Практически весь поступающий в митохондрии пируват быстро окисляется до ацетил-КоА.
Из продуктов окисления пирувата С02 — конечный продукт обмена, энергетической ценности не представляет; восстановленный НАД — богатое эвергией соединение, водород его поставляется на дыхательную цепь; ацетил-КоА поступает в цикл Кребса, локализованный внутри митохондрий.
Окислительная ферментативная система цикла Кребса
Главной ферментативной системой, выполняющей роль генератора водорода для дыхательной цепи, является цикл Кребса. Начало изучения реакций этого цикла было положено работами Сент-Дьердьи, который установил каталитическую роль фумарата, малата, сукцината в окислении эндогенных субстратов измельченной мышечной ткани.- Английский ученый Кребс на основании собственных экспериментов и данных Сент-Дьердьи предположил, что в клетках имеется окислительная циклическая система реакций, которую он назвал циклом лимонной кислоты, так как считал, что первым продуктом цикла является лимонная кислота (цитрат). Этот цикл также назвали циклом трикар- боковых кислот, поскольку в -то время не было точно известно, действительно ли первым субстратом цикла является лимонная кислота. Впоследствии показали, что этот цикл служит главной ферментативной системой окисления остатков уксусной кислоты (ацетил-КоА) и что первой реакцией его является синтез лимонной кислоты. Однако чаще всего этот цикл называют циклом Кребса, впервые установившего последовательность реакций в этом процессе.
Отдельные реакции цикла Кребса
Ацетил-КоА, образующийся при окислении пирувата, жирных кислот и аминокислот, включается в цикл Крсбса.
1. На первой стадии происходит синтез лимонной кислоты, или цитрата, при участии фермента цитратсинтазы.
C-S-KoA НО—С—СООН
Ан.
dooH
Углерод метильной группы ацетила взаимодействует с атомом углерода оксалоацетата (помечен звездочкой). Промежуто»Шым соединением является, как считают, цитрил-КоА, который гидролизуется с образованием свободного цитрата. Гидролиз богатой энергией тиоэфирной связи сдвигает равновесие реакции в сторону образования цитрата и делает реакцию практически необратимой (AG=—37, 5 кДж/моль) в физиологических условиях. Потери энергии в ходе гидролиза цитрил-КоА обеспечивают включение ацетильного фрагмента в цикл Кребса с образованием цитрата.
| сн2 . н—С—СООН н—с—он СООН |
2. Второй фермент цикла Кребса — аконитатгидратаза — катализирует обратимые превращения трех трикарбоновых кислот — цитрата, цис-акони- тата и изоцитрата:
СООН
.. к
: НО|—С—СООН,
.. I ~ f >
н—С—Н н20
СООН цитрат (91%)
Равновесие в системе устанавливается при соотношении трех субстратов, указанном в уравнении реакции. Аконитатгидратаза катализирует присоединение протона и гидроксила воды в граиг-положении по месту двойной связи цыс-аконитата. При этом образуется либо цитрат, либо изоцитрат. Особенностью этого фермента является необходимость для реакции ионов Fe2+, образующих металлосубстратный комплекс. Чтобы сместить равновесие акони- тазной реакции в ту или другую сторону, надо расходовать изоцитрат или цитрат.
| -СООН + KoASH |
3. Ферментов, расщепляющих цитрат внутри митохондрий, нет, а превращение изоцитрата катализируется третьим ферментом цикла Кребса — изоцитратдегидрогеназой. Как всякая дегидрогеназа, этот фермент имеет кофермент — акцептор водорода, отщепляемый от субстрата. Истинная изоцитратдегидрогеназа цикла Кребса — НАД-зависимый фермент, который содержится только в матриксе митохондрий и катализирует дегидрирование изоцитрата по уравнению
| Н—С—СООН • |
| НС—СООН I с=о |
| Mn'1*1^ НАД H+H* |
Одновременно идет декарбоксилирование промежуточного продукта реакции (оксалосукцинат) на поверхности фермента.
Другая, НАДФ-зависимая, изоцитратдегидрогеназа находится в основном в цитоплазме клетки (—-80%), и лишь небольшие количества ее присутствуют в митохондриях. Эта дегидрогеназа участвует в реакциях синтеза.
Реакция, катализируемая изоцитратдегидрогеназой, требует присутствия ионов Мп2+ или Mg н является практически необратимой (Д0 = = —20, 8 кДж/моль). Потери в энергии при декарбоксилированин обеспечивают непрерывность-утилизации изоцитрата, что в свою очередь способствует смещению равновесии аконитатгидратазной реакции в сторону образования изоцитрата из цис-аконитата.
4. 2-Оксоглутарат превращается полиферментным 2-оксоглутаратдегидро- генаэным комплексом, который по действию сходен с пнруватдегидрогеназным комплексом. Сходство в их механизме действия не случайно, так как оба фер- • ментных комплекса катализируют окисление а-кетокислот, 2-Оксоглутаратде-.гидрогеназный комплекс (четвертый фермент цикла Кребса) окисляет 2-оксоглутарат по уравнению:
| соон < 1н, —222 Lo ' «ЮН |
| к к и I S-KoA |
| глутаратдегидпдг» |
| -+- НАД • Н +.Н* + СОз |
5. Продукт этой реакции сукцинил-КоА относится к числу богатых энергией соединений, поэтому на следующей стадии цикла происходит перенос богатой энергией связи этого субстрата в макроэргические фосфатные связи. Эта реакция называется фосфор ил ированием на уровне субстрата или субстратным фосфорилированием. Благодаря этому процессу сохраняется энергия в макроэргических связях АТФ. Процесс катализируется сукцинат- тиоки- назой (обозначенной в уравнении «Е»):
а) Сукцинил-КоА + Н, Р04 + Е«£ Е-сукцнннл ~ Р03Н,
б) Е-сукцнкнл ~ POjHj^t Е ~ РО, Н, + Сукцинат
в) E~POjH, +ГДФ^Е + ГТФ
Акцептором фосфорила в этой реакции является ГДФ, поэтому энергия сначала аккумулируется в фосфатных связях ГТФ. Затем с помощью фермента нуклеозиддифосфаткиназы, связанного с внутренней мембраной митохондрий, происходит перенос фосфорила с ГТФ на АДф с образованием АТФ:
ГТФ + АДФз^ГДФ + АТФ
6. Сукцинат подвергается превращению с участием сукцинатдегидро- геназы. Особенностью этого фермента является то, что акцепторами электронов и протонов, отщепляемых от сукцнната, служат ФАД и железосеропро- теид, содержащий негеминовое железо (FeS). Железосеропротеиды связаны с субъединицами сукцинатдегндрогеназы. Кроме того, это единственный фермент цикла Кребса, прочно связанный с внутренней мембраной митохондрий. Он как бы «утоплен» своей гидрофобной частью в лнпидную часть мембраны, а активный центр фермента обращен в матрикс, где в растворенном внде находится сукцинат. При дегидрировании сукцината электроны переходят через негеминовое железо железосеропротенда к ФАДу, который является конечным акцептором электронов и протонов в этой реакции:
соон I
е; кц|)натдегкдрогян131 СН
^ % ' н1
сувиимт фумарк
Сукцннатдегидрогеназа катализирует отщепление от сукцината атомов водорода, находящихся в троне-положении. Поэтому образуется гране-форм а дикарбоновой кислоты — фумарат, а не цис-форма — малеат. Сукцинат- дегидрогеназная реакция обратима.
7. На следующем этапе происходит стереоспецифическое присоединение протона и гидроксила воды к фумарату, катализируемое фумаратгидратазой, по уравнению
соон соон
d: —н. но—с—н
и +н.о«> " " Р'т" " Г" '1 I н-с Н-С-Н
<!; оон (}: оон
фуиярвт uajaT
Следовательно, этот фермент цикла Кребса обладает стереохимнческой субстратной специфичностью.
| СООН Н—С—Н Н—С—Н СООН |
8. Завершающей стадией цикла Кребса является регенерация оксало- ацетата. Это происходит путем окисления палата, катализируемого малат- дегидрогеназой.
Малатдегидрогеназа цикла Кребса — НАД-зависимый фермент и имеет несколько изоферментов.
Реакция, катализируемая этим ферментом, обратима и описывается
| СООН НО—О—Н н—н I СООН |
| м& латаегидрогеназа ^ —: над над н+н |
Существует и НАДФ-зависимая малатдегидрогеназа, но она сосредоточена преимущественно вне " митохондрий (в цитозоле). Этот фермент одновременно с дегидрированием катализирует и декарбоксилирование субстрата:
^оон
| со, + с=о |
| Г' СООН |
НО—С—Н (аеирбокснднрующм)
надф надф h+h +
Сравнив эти два фермента, можно видеть, что НАДФ-зависимый фермент не имеет отношения к циклу Кребса, так как под действием этого фермента lie происходит регенерации оксалоацетата, необходимого для замыкания

|
| Н3Р04» ГДФ ------- ----- |
| I — цитратсинтаэа, 2 — акоянтэтгидратаэа; 3 — иэпинтрэтяегидрогенаэа; 4 — З-оксоглутэратдегидрогеназный комплекс: 5 — сукцниилтиокннязэ: 6 — сукин натаегндрогеназа; 7 — фумэрэтгидратазэ, 8 — малатдегидрогеназа; ПДГ — пкруватдегидрогекаакый комплекс |
цикла. НАДФ-малатдегидрогеназа необходима как генератор НАДФ-Н2 для синтетических процессов или как фермент, способствующий восполнению малата, расходующегося в других реакциях.
Общая последовательность реакций цикла Кребса представлена на рис. 34. Хотя цикл Кребса изображают в виде замкнутого ферментативного процесса, следует обратить внимание на одну его особенность: обратимость ферментативных реакций на участке от сукцината до оксалоацетата. Поэтому в митохондриях эта ветвь может работать в обратном направлении, т. е. оксалоацетат может превращаться в метаболиты цикла Кребса вплоть до сукцината. Такая возможность представляется, когда нарабатывается оксалоацетат из других субгтпятпр с помощью вспомогательных реакций.
Дополнительное образование: молекул оксалоацетата необходимо в ситуациях, при которых в ходе распада веществ образуется много ацетил- КоА (например, при интенсивном окислении жирных кислот, пирувата, некоторых аминокислот). Если количество оксалоацетата недостаточно для синтеза из него и ацетил-КоА цитрата, то цикл Кребса не успевает перерабатывать ацетильные остатки, и они используются в других ферментативных процессах.
Суммарное уравнение превращения ацетил-КоА ферментами цикла Кребса имеет вид
СН3—CO~SKoA + 2Н, 0 + HsP04 + АДФ ■ " " " «кР€б",
--»■ 2СОа + ЗНАД. Н + Н* + ФАД • Н, + АТФ -I- KoA-SH
Круговорот веществ в цикле Кребса организован столь целесообразно, что ферменты цикла по ходу его используют молекулы воды, имеющейся в изобилии, для производства водорода. Источником избыточных пяти атомов водорода являются две молекулы воды, присоединяющиеся к субстратам на стадиях превращения цитрнл-КоА в цитрат и фумарата в малат, а также неорганический фосфат, участвующий в реакции субстратного фосфор ил и- рования — образовании сукцината из сукцинил-КоА. Поскольку молекулы воды служат источником водорода, можно сказать, что вода выполняет энергетическую роль в животных клетках.
Биохимические функции цикла Кребса
1. Интегративная — цикл Кребса является своеобразным метаболическим «коллектором», который объединяет пути катаболизма углеводов, липидов и белков.
2. Амфмболическая — цикл Кребса выполняет двойственную функцию:, ката бол ическую, поскольку в нем происходит распад ацетильных остатков, н анаболическую, поскольку субстраты цикла Кребса используются на синтез других веществ. Так, оксалоацетат идет на синтез аспарагиновой кислоты и глюкозы, 2-оксоглутарат — на синтез глутаминовой кислоты, сукцинат — на синтез гема.
3. Энергетическая — в ходе реакций цикла Кребса образуется одна молекула АТФ на уровне субстрата на 1 моль поступившего ацетил-КоА.
4. Водороддонорная (или водородгенерирующая) — цикл Кребса является основным генератором водорода для дыхательной цепи. В цикле Кребса
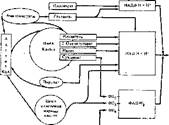 Ркс. 35. Схема окислительных процессов в митохондриях — генераторов водорода в форме НАД • Н„ НАДФ - Н: н ФАД • Н, для дыхательной цепи (ФП* ФП„, ФГЦ — флавонротеиды)
Ркс. 35. Схема окислительных процессов в митохондриях — генераторов водорода в форме НАД • Н„ НАДФ - Н: н ФАД • Н, для дыхательной цепи (ФП* ФП„, ФГЦ — флавонротеиды)
|
образуется 4 пары атомов водорода, три из которых соединены с НАД и одна
На носледней функции цикла Кребса следует остановиться особо. Прежде всего, необходимо напомнить, что все процессы, «питающие» цикл Кребса или остатками уксусной кислоты, т. е. ацетил-КоА, или другими промежуточными продуктами цикла, т. е. ди- и трикарбоновыми кислотами, обеспечивают работу цикла Кребса и его функцию генератора водорода для дыхательной цепи. К этим процессам относятся (рнс. 35) цикл окисления жирных кислот, и пирувата (источники ацетил-КоА), реакции распада углеродного скелета аминокислот (источники ацетнл-КоА и дикарбоновых кислот). Торможение процессов, ведущих к образованию ацетил-КоА или метаболитов циила Кребса, из других веществ, выключает цикл Кребса из работы. Дыхательная цепь лишается главного источника поступления водорода, использующегося на образование энергии.
Биохимические функции цикла Кребса указывают на то, что уксусная кислота и любое вещество, являющееся непосредственным компонентом цикла Кребса, должны быть хорошим Источником энергии и их можно потреблять с пищей как ценные энергетические вещества, лишь бы они, поступав в клетку, могли достигнуть ферментной системы цикла Кребса, расположенной внутри митохондрий. Ацетат в клетках может активироваться и превращаться в ацетил-КоА, а значит, для уксусной кислоты это предположение справедливо. То же относится к некоторым субстратам цикла, проникающим через митохондркальную мембрану, особенно к субстратам дегидрогеказ: изо- цитрату, 2-оксоглутараТу, сукцинату и малату. Возможности их использования 202 как энергетически ценных препаратов для медицинских целей и показания к назначению сейчас изучаются.
Вспомогательные дегидрогеназные реакции — доноры водорода в митогондрмях
Донорами водорода кроме цикла Кребса являются отдельные реакции окисления жирных кислот, пирувата, глутамата, изоцитрата (катализируемая НАДФ-зависимой изоцнтратдегидрогеназой), а-глицеролфосфата (см. рис. 35). Эффективность этих реакций значительно ниже, чем цикла Кребса. Более того, в отличие от цикла Кребса отщепление водорода в реакциях дегидрирования этих субстратов сопровождается образованием продуктов обмена, которые необходимо утилизировать. А для этого нужен циил Кребса. Значит, вспомогательные окислительные ферментные реакции — доноры водорода—самостоятельно не могут долго функционировать и лишь в присутствии цикла Кребса их функция эффективна.
Распределение киугримитохондрмального фонда водорода
При дегидрировании субстратов в митохондриях происходит связывание водорода с коферментами-переносчиками, которые специфичны для каждой дегидрогеназы. Весь водород внутри митохондрий поступает в дыхательную цепь по трем каналам. Основная часть водорода связана с НАД в виде НАД» Н2, так как большинство дегндрогеназ внутри митохондрий являются НАД-завнсимымн. Вторую часть внутримитохондриального водорода составляет тот, что связан с НАДФ (НАДФ-Н + Н+). Он образуется при дегидрировании НАДФ-зависимых изоцитратдегидрогеназы или глутаматдегидро- геназы. Третий поток водорода поступает при действии на субстраты флави- новых дегндрогеназ (флавопротеидов), кофер мента ми которых служит ФАД (см. рис. 35).
Распределение водорода, связанного с разными коферментами, раалич- но: НАД • На и ФАД • Hs используются в окислительных процессах, а НАДФ • Н2 —преимущественно для восстановительных синтезов. Во внутренней мембране митохондрий имеется фермент трансгидрогеназа, регулирующий распределение водорода между НАДФ" 1" и НАД+.
Трансгидрогеназа катализирует перенос водорода между двумя никотин- амиднуклеотидами:
НАДФ • Н, + НАД"» 3£ НАДФ* + НАД.. Н,
Если необходимо использ.овать водород НАДФ-Н2 не для синтезов, а для окисления, то он перебрасывается к НАД+ с участием трансгидрогеназы.' Однако чаще используется обратная реакция, поскольку в митохондриях активны НАД-зависимые дегидрогеназы н нарабатывается много НАД * Н3. На перенос водорода от НАД • Н2 к НАДФ+ затрачивается энергия. Образовавшийся НАДФ • Н2 используется в синтезе различных веществ внутри митохондрий.
3. Тканевое дыхание и окислительное фосфорилированиё
Водород используется как главное топливо для образования энергии. В митохондриях поток электронов от водорода устремляется к их конечному акцептору кислороду. При этом образуются молекулы воды, которая в энергетической шкале биологических веществ занимает низшую ступеньку и является конечным продуктом тканевого дыхания. Следовательно, тканевое дыхание есть окислительно-восстановительный процесс, связанный с образованием воды при переносе электронов от водорода на кислород.
Первые представления о тканевом дыхании связаны с Лавуазье, который один из первых указал на то, что жизнь поддерживаекм кислородом. Он назвал дыхание процессом биологического «горения», подобным горению угля, только очень медленным.
В 1897 г. была обоснована первая гипотеза тканевого дыхания, названная гипотезой перекисного (пероксидного) окисления. Ее разрабатывали независимо друг от друга А. Н. Бах в России и Энглер в Германии. Суть данной гипотезы состоит в том, что при дыхании, как считали авторы, происходит активирование молекул 02 за счет энергии самоокнсляющихся веществ, образование пероксидов и разложение их с участием другого вещества:
1) О - О-" —О—О— (активный кислород)
2) —О—О— + А (субстрат) —'(пероксид)
3) А< ^ + В (второй субстрат) ДО + BQ
Для указанных целей необходимо последовательное действие двух ферментов — оксиееназы и пероксидазы. Впоследствии оказалось, что это не главный, а частный случай окисления веществ при дыхании. Сейчас известно, что описанный тип медленного окисления органических веществ имеет место в микросомах печени, а не в митохондриях.
Идея активирования кислорода как основного механизма тканевого дыхания разрабатывалась известным немецким ученым Варбургом, создавшим первые аппараты для изучения тканевого дыхания. Он считал, что активирование кислорода есть ключевой процесс в тканевом дыхании, в результате чего кислород соединяется с водородом и образуется вода. В 1912 г. Варбург открыл гемосодержащий протеид, названный впоследствии цитохромоксидазой, которая активирует кислород. Однако после открытия в том же году Бателли и Штерном дегидрогеназ ученых захватила идея активирования не кислорода, а водорода субстрата как основного звена тканевого дыхания. В. И. Палладии (1912) предложил схему дыхания, по которой дегидрирование является важнейшим звеном дыхания: А. Нг (субстрат) Д'пдаогеназы, |/3о8^н, 0
Вскоре Виланд и Тунберг доказали, что возможно активирование водорода субстрата с помощью дегидрогеназы. Гипотеза Палладина получила подам тверждение. Примирить дегндрогеназную концепцию Палладина и оксидаз- ную Варбурга в тканевом дыхании удалось после открытия в 1933 г. Кейли- ном цитохромов, являющихся промежуточными переносчиками электронов от водорода к кислороду. На самом деле Кейлин переоткрыл цитохромы, которые были впервые описаны Мак-Мунном в 1886 г. и названы им гистогема- тинами.
Как часто бывает, истина оказалась посередине: и активирование водорода субстрата с участием дегндрогеназ, и активирование кислорода с участием оксид аз являются необходимыми звеньями тканевого дыхания.
На современном этапе знаний тканевое дыхание представляется полиферментной цепью переноса электронов и протонов от субстрата — донора водорода к кислороду. Эта цепь переносчиков называется дыхательной цепью.
Структура и функция дыхательной цепи
Дыхательная цепь—это своеобразный конвейер по переносу протонов и электронов от восстановленного НАД (НАД • Н + Н+), образующегося при действии на субстрат НАД-зависимых дегндрогеназ, или от восстановленного ФАД (ФАД • Н2), образующегося при действии на субстрат флавинзависи- мых дегндрогеназ, к кислороду. Дыхательная цепь состоит из следующих переносчиков протонов и электронов: флавопротеида-1 (ФП), содержащего в качестве кофермента ФМН, кофермента Q (или убихннона), двух желе- зосерных белков, содержащих негеминовое железо, и цитохромов Ь, с,,.с, а, а3 (рис. 36).