
Главная страница Случайная страница
КАТЕГОРИИ:
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Механизм сопряжения дыхания и фосфорилирования в митохондриях 2 страница
|
|
 он
он
|
с Не—о—Р=0
 н он н он
н он н он
|
Остальные гексокиназы фосфорилнруют не только глюкозу, но н другие гексозы (D-фруктозу, D-манйозу, D-глюкозамин). Поскольку Km гексокиназ для глюкозы низка (/Гт=Ю-'5—Ю-6 М), то они фосфорилнруют глюкозу и другие гексозы при обычных их концентрациях в клетках. Гёксокиназа I особенно активна в почках, печени; гёксокиназа II — в мышечной и жировой тканях, гёксокиназа III — в печени, селезенке. Гексокиназы II и IV реагируют на действие гормонов (например, инсулина), что позволяет считать их приспособительными ферментами. Характерно, что в печени имеется весь набор изоферментов гексокиназы, что говирит о разнообразии возможностей печеночных клеток в «улавливании» глюкозы.
| он |
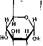
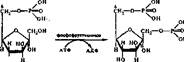
2. Изомеризация глюкозо-6-фосфата во фруктозо-6-фосфат. Эта реакция катализируется ферментом глюкозофосфатизомеразой. Она обратима и протекает по уравнению
он
| -о—р=о |
|
| сн, —о—р=о |
| > н |
| н он глю roio-6-ф осф ат |
| сн2- |
|
| ОН |
| 20Н |
| гтою-6-фосфат |
глю ко зофосфати юмераи
Равновесие устанавливается при соотношении глюкозо-6-фосфат/фруктозо- 6-фосфат — 70/30. Глюкозофосфатнэомераза — очень специфичный фермент Он действует только на тлюкозо-6-фосфат (прямая реакция) и. фруктозо-6- фосфат (обратная реакция).
3. Фосфорилированиё фруктозо-6-фосфата с образованием фруктоао- 1, 6-бнсфосфата. На эту реакцию гликолиза затрачивается еще одна молекула АТФ (для реакции необходимы ионы Mg2" 1"). Она катализируется ферментом фосфофрукяжиназой по уравнению
|
| HQ фругго*> -6-фосф«т |
| фруктеэо-1, б-бнсфосф«т |
В реакции, катализируемой фосфофруктокиназой, происходит значительное падение свободной энергии, поэтому она практически необратима. Это вторая необратимая реакция гликолиза. Фосфофруктокиназа принадлежит к аллостерическим, или регуляторным, ферментам, и имеет свойственную, таким ферментам сложную четвертичную структуру (мол. масса 360 000).
Фосфофруктокиназа — «ключевой» фермент гликолиза, который не только лимитирует скорость всего процесса (из-за необратимости реакции), но н управляется различными изо- и аллостерическими регуляторами. Фермент активируется своим субстратом (фруктозо-6-фосфат) и продуктами реакции — фруктозо-1, 6-бисфосфатом и АДФ, а также АМФ, Ф, и цАМФ. Ингнбируют фермент повышенные концентрации АТФ, т: е. свой субстрат, и цитрат. Интересно, что АМФ, присутствующий в клетке, облегчает связывание АТФ с активным центром фермента. Поэтому АТФ сначала используется как субстрат, а затем, связываясь с аллостерическим центром, прекращает фосфофруктокиназную реакцию.
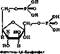
4. Расщепление фруктозо-1, 6-бисфосфата на глнцеральдегнд-3-фосфат и днгидроксиацетомфосфаг. На следующем этапе фруктозо-1, 6-бисфосфат расщепляется на две фосфотриозы, из-за чего раньше гликолиз называли дихотомическим путем превращения глюкозы.
|
Реакция катализируется ферментом фруктозобисфосфат-альдолазой по уравнению
м—у"»1
с—о + сн—он
Т \_ja
сн, он c^j
Изменение свободной энергии этой реакции в физиологических условиях незначительно, поэтому она обратима.
Альдолаза состоит из четырех субъединиц. Молекулярная масса фермента около 150 ООО. У человека и животных имеется три типа изоферментов альдолаз: мышечный (А), печеночный (В) и мозговой (С), которые отличаются по аминокислотному составу полипептидных цепей и свойствам. Каждый из трех типов альдолаз состоит из одинаковых типов субъединиц (например, Av В4, Q). Они встречаются преимущественно в тех органах, по которым получили свое название. Однако в печени, мозгу, мышцах встречаются гибридные изоферменты: АС3, А2С2, А2В2, АВ3 и др.
Кроме фруктозобисфосфат-альдолазы в клетках печени (но не в других органах) встречается другая специфическая альдолаза: фруктозо-1-фосфат альдолаза. Она катализирует обратимую реакцию: _
D-Фруктозо-1 -фосфат D-Глицеральдегид + D-Дягидроксиаиетоифосфат Этот фермент участвует в усвоении фруктозы.
' 5. Взаимопревращение триозофосфатов. Поскольку в дальнейших реакциях гликолиза используется только одни нз двух триозофосфатов — глицеральдегид-3-фосфат, то необходим фермент, осуществляющий превращение другого триозофосфата (дигидроксиацетонфосфата) в глицераль- дегид-3-фосфат. Эту функцию в гликолизе выполняет триозофосфатизоме- раза, катализирующая реакцию
НС =о Н, С—он
H(t-OH TpHotofrQc^aTmoMtpaaa^ ^
I H-------------- 1
H, C—OPOjH, H, C—OPO, Hj
D-гимральдегнд-Э-фосфат О-оягндроксяамтоифосфат
. Реакция обратима, но равновесие в ней достигается, если доля дигидроксиацетонфосфата составляет 94% от суммы триозофосфатов. Чтобы сдвинуть равновесие в сторону глицеральдегид-3-фосфата, необходимо, чтобы он непрерывно расходовался. Эту функцию выполняет следующий фермент гликолиза.
6. Окисление глицеральдегид-3-фосфата до 1, 3-дифосфоглнцерата. Эта
реакция называется гликолитической оксидоредукцней и выполняет важную роль, так как в ней происходит не только окисление субстрата, но и обра- зовайие богатого энергией продукта. Реакция катализируется глицеральде- гид-3-фосфат-дегидрогеназой по уравнению
о
II
нс=0 С—OPOJHJ
H(LoH +НАД+ + Н3РО, ГлИц> репьдСг«д.э-ф«1нт-д^Ядр°генаЗЭ> H(j; _OH + НАД ■ Н + Н * Hjd: —оро3н2 H2i—OPOjHJ
Р-глкерадьде- 14-днфосфотлв-
ги-З- фосфат оерат
Реакция обратима, равновесие ее сдвинуто влево.
Глицеральдегид-З-фосфат-дегидрогеиаза состоит из четырех одинаковых субъединиц (молекулярная масса фермента 140 000). В составе фермента имеется НАД. Важную роль в катализе играет SH-группа активного центра. Механизм действия этого фермента протекает в несколько стадий:
а) связывание НАД+ с активным центром ферме 1та (Е—SH)
НАД
Е—SH + НАД+
б) связывание глицеральдегид-3-фосфата (R—СН=0) с SH-группой фермента
он
в) восстановление НАД за счет дегидрирования субстрата внутри активного центра фермента.НАД+.НАД.
+ H*
•S—СН—К S~C—R
1 11 он о
г) восстановление внешнего НАД" 1"
^над-Н
^S ~ С—R
д) фосфоролиз фермент-субстратного комплекса с образованием 1, 3- дифосфоглицерата
-НАД* НАД
Е^ + Н, Р04 + R—С—0Р08Н2
S~C—R S II
Продукты этой реакции НАД-Н2 и 1, 3-дифосфоглицерат блокируют фермент, поэтому необходимо в ходе реакции непрерывно их использовать.
7, Перенос фосфатной группы с 1, 3-дифосфоглицерата на АДФ. 1, 3-дифосфоглицерат — богатое энергией соединение, оно используется для образования АТФ (первое гликолитическое фосфолирование) на уровне субстрата. Реакция катализируется фосфоглицераткиназой по уравнению
J
OPOjHj фосфоглтератхняам
НС—ОН г ~ Н—С—ОН
| адф атф j
Н 2с— OPOJHj HjC— OPOjH J
Ц-днфосфоглииерат }-фосфогляиер*т
Реакция экзертоническая, сопровождается значительным падением свободной энергии, и поэтому равновесие ее сдвинуто вправо. Благодаря фосфо- глнцераткиназе быстро используется 1, 3-дифосфо" глицерат, что благоприятствует течению предыдущей реакции — окисления глицеральдегид-3-фосфата. При избытке продукта 3-фосфоглицерата фосфоглицераткиназная реакция обратима.
8. Изомеризация 3-фосфоглицерата в 2-фосфоглицерат. Эта реакция, при которой фосфатная группа из положения 3 переносится в положение 2, катализируется фосфоглицерат-фосфомутазой:
соон соон
I „„ж......,.. I
НС—ОН ''" -" •' НС—OPOjH,
I Mg»+ I
HjC—0P0jHs H2(i—он
I 3-фосфо-гди г фосфо-шк-
Реакция обратима, протекает с небольшим падением свободной энергии и требует ионов Mg2+.
Кофактором этого фермента является 2, 3-дифосфоглицерат, который сначала дефосфорилируется, превращаясь в 2-фосфоглицерат, а затем восполняется за счет фосфорилирования 3-фосфоглицерата:

|
| 2J- дифоефогл ицерат |
9. Дегидратация 2-фосфоглицерата с образованием фосфоенолпирувата.
Эта реакция, в ходе которой образуется богатая энергией связь, катализируется енолазой (еноилгидратазой) по уравнению
соон соон
I енонлгкдратиа |
H—С—ОР03Н2 * * С—O-POjHJ
Н, С—ОН, НаО CH2
3-фосфоглицер»т фосфоенолпирумт
Реакция протекает с небольшим изменением свободной энергии и потому обратима.
10. Перенос фосфатной группы с фосфоенолпирувата на АДФ(второе гликолитическое фосфорилированиё). Высокоэнергетическое соединение — фос- фоеиолпируват используется на этой стадии для образования АТФ на уровне
в—271
субстрата. Реакция катализируется пируваткиназой и протекает с участием ионов Mg2+ по уравнению
соон
| лируват*ии«м
С—О—POJHj- 1 1 ^ " s.
II f М«»+Х
гн. ' V.
Реакция нроЛрятнма в физиологических условиях, так как протекает с большим падением свободной энергии. Пируваткиназа угнетается продуктами реакции — АТФ и пируватом — по механизму обратной связи. Кроме того, фермент инактивируется при связывании с ионами Са2+. Активируется фермент фруктозо-1, 6-бисфосфатом, неорганическим фосфатом и одновалентными катионами К+, Na+, Pb+, Cs+, NHJ. Особенно сильным физиологическим активатором реакции являются ионы К+.
Пируваткиназа состоит из четырех субъединиц (молекулярная масса фермента около 240 000). Были выделены два изофермента пнруваткиназы; М (мышечная форма) и L (печеночная форма), различающиеся по чувствительности к регуляторам — АТФ и фруктозо-1, 6-бисфосфату. В печеня эмбриона присутствует М-форма изофермента, которая заменяется на взрослую L-форму.
11. Восстановление пирувата до лактата. Эта реакция катализируется заключительным ферментом гликолиза — лактатдегидрогенаэой по уравнению
соон соон
I лаггатлегилрогвнам 1
С=0» н—с—он
I ^ +!
Лактатдегидрогеназная реакция обратима; равновесие ее смешено в сторону образования лактата из-за большого отрицательного значения свободной энергии. В тканях человека и животных имеется пять иэоферментов лактатдегидрогеназы, состав которых определяется особенностями окислительного метаболизма тканей. Изоферменты ЛДГ4, ЛДГБ (М-типы ЛДГ) работают эффективно в анаэробных условиях; ЛДГ,, ЛДГг (Н-типы ЛДГ) — в аэробных, когда пируват быстро окисляется, а не восстанавливается в лактат.
В результате гликолитнческого процесса из глюкозы образуется лактат. Лактат является «тупиком» в обмене веществ, поскольку не вступает ни в один биохимический процесс, кроме обратного превращения в пируват. При накоплении лактата в клетках может нарушаться рН внутриклеточной среды и останавливаться гликолиз, поэтому лактат удаляется из клеток как метаболический «шлак». Однако в некоторых органах, например в сердце, он окисляется и используется как энергетическое вещество. 226
Энергетический баланс и биологическая фувкция гликолиза
Гликолиз можно рассматривать как внутренний окислительно-восстановительный процесс, в котором происходит образование двух молекул НАД • Н2 на стадии дегидрирования глицеральдегид-3-фосфата, а акцептируется водород двумя молекулами пирувата с образованием лактата. Суммарное уравнение гликолиза выглядит следующим образом:
Глюкоза + 2HsP04 + 2 АДФ -2 Лактат + 2 АТФ + Н20
На стадиях фосфорилирования глюкозы и фруктозы (стадии 1 и 3) расходуется две молекулы АТФ. Если принять во внимание, что весь дигидро- ксиацетонфосфат (на 5-й стадии) переходит в глииеральдегид-3-фосфат, т. е. дает наряду с имеющейся вторую молекулу глицеральдегйд-3-фосфата, то далее фактически происходит последовательное превращение двух молекул этой фосфотрнозы. Поэтому на двух стадиях гликолитического фосфорилирования, катализируемых фосфоглицераткиназой и пируваткнназой, образуется по две молекулы АТФ. Итого, чистый выход АТФ составляет две молекулы на молекулу расщепленной глюкозы. Такова энергетическая ценность гликолиза.
Из данных по изменению свободной энергии можно рассчитать примерную эффективность гликолиза. Расщепление глюкозы до двух молекул лактата сопровождается освобождением примерно 195 кДж/моль, а для образования двух молекул АТФ из АДФ.и Н3Р04 требуется затрата в физиологических-условиях около 90— 100 кДж/моль. Следовательно, эффективность гликолиза составляет около 50%. 4
Таким образом, гликолиз представляет собой практически необратимый процесс, который полностью Смещен в сторону образования лактата. «Узкими» местами гликолиза, лимитирующими скорость всего процесса распада глюкозы, служат три ферментных звена: гексокиназа, фосфофруктокиназа и пи- руваткиназа, катализирующих необратимые реакции. Эти ферменты являются своеобразными водителями ритма гликолиза. Воздействуя на них, ^ожно регулировать скорость всего поли ферментного процесса. Кстати, эти ферменты активируются неорганическим фосфатом или. АДФ и тормозятся продуктом гликолиза'— АТФ. Очевидно, чем больше расход АТФ в клетке, тем актив- яее гликолиз н наоборот. Несмотря на то что гликолиз дает малый валовый выход энергии (всего 2 АТФ на 1 моль глюкозы), это единственный процесс в клетках организма, продуцирующий энергию в отсутствие кислорода.-Этим и обусловлена его биологическая роль. При кризисных ситуациях в организме, когда по тем или иным причинам нарушено поступление или потребление кислорода, гликолиз является единственным средством скорой энергетической помощи для сохранения жизнедеятельности клеток. Поэтому при гипоксии (кислородное голодание тканей) гликолиз играет важную энергетическую роль. Он протекает во всех клетках и тканях; его возможности таковы, что они обычно • превышают потребности в расщеплении углеводов, т. с. ферменты гликолиза в.клетках находятся в избытке. В эритроцитах, где отсутствуют митохондрии, гликолиз вообще единственный процесс, продуцирующий АТФ и поддерживающий их целостность и функции.
2. Ра: лад гликогена (гликогенолиз)
Другие углеводы (полисахариды и моносахариды) в ходе распада подключаются к одному из этапов гликолиза и далее превращаются до лактата уже известными ферментами. Запасным углеводом в тканях млекопитающих является гликоген, при распаде которого извлекается энергия. Процесс его распада называется гликогенолиэом. Распад гликогена происходит путем фосфоро- лиза и гидролиза:
Гликоген
| (+h*Jpo4) ДоГ |
Глюкоэо-1-фосфат Глюкоза
К
Глюкоэо—6 -фосфат
Для каждого из этих процессов имеются свои ферменты. Фосфоролиз гликогена осуществляется с помощью гликогенфосфорилаз и вспомогательного фермента этого процесса олиго-\, 6-гликозидазы. Гликогекфосфорнлаза, или просто фосфорилаза, существует в двух формах — А и В. Фосфорилаза А более активна, чем фосфорилаза В. Отличаются они друг от друга тем, что фосфорилаза А—тетрамер (молекулярная масса 360 000), а фосфорилаза В — димер (молекулярная масса 180 000). В состав фосфорнлаз входит пири- - доксальфосфат, стабилизирующий молекулы ферментов. Для фосфорилаз обязателен сложный процесс активирования, который состоит в присоединении фосфатных групп к субъединицам фосфорилазы по схеме
Фосфорилаза В+4 АТФ А|СТКВЯ*Я frocfoP" " " В фосфорилаза А + 4 АДФ
Этот процесс протекает необратимо и катализируется активной киназой фосфорилазы В. Последняя активируется цАМФ-зависнмой протеинкинаэой. В целом имеет место каскадный механизм активирования (рис. 39).
Активная фосфорилаза А, содержащаяся в гиалоплазме вместе с грану-1 лами гликогена, отщепляет от полисахарида остатки глюкозы, вызывая фосфоролиз а-1, 4-гликозидных связей в линейных цепях гликогена. Поскольку фосфорилаза не действует на а-1, 6-гликозидные связи (участки разветвления) гликогена, то образуются остаточный декстрин и глюкозо-1 -фосфат. Помогает расщеплять гликоген олиго-1, 6-глюкозидаза, которая «устраняет» участки ветвления полисахарида, разрывая 1, 6-свнзи, и облегчает дальнейшее действие глнкогенфосфорилазы.
Гидролиз гликогена, его называют также амилолизом, происходит с участием а-амилазы и у-амилазы (а-глюкозидаза). Действие а-амилазы такое же,
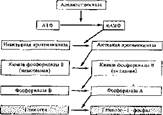 Рис. 39. Механизм активирования фосфор ил азы В (по Са- зерленду)
Рис. 39. Механизм активирования фосфор ил азы В (по Са- зерленду)
|
как и пищеварительных амилаз, у-Амилазы бывают кислые (локализованы в лизосомах) и нейтральные (локализованы в гиалоплазме и микросомах). Гликоген расщепляется а-амилазой на олигосахариды (преимущественно мальтозу); у-амилазы отцепляют концевые-остатки глюкозы, связанные в полисахариде как а-Г, 4-, так и в-1, 6-глнкозндными связями. В результате гликоген может полностью гидролизоваться до свободной глюкозы.
Вовлечение продуктов гликогенолиза в гликолиз происходит следующим образом. Глюкозо-1-фосфат превращается с помощью фосфвглюкомутазы в глюкозо-б-фосфат, который распадается далее до лактата обычным путем. Кофактором фосфоглюкомутазы является глюкозо-1, 6-диосфат, который выполняет те же функции, что 2, 3-дифосфоглнцерат в реакции, катализируемой фосфоглнцератмутазой.
Гидролитический распад гликогена обычно происходит в печени. Он используется для быстрой мобилизации гликогена с целью поступления глюкозы в крбвь и вовлечения ее в гликолиз внёпечеиочных тканей.
3. Распад других моносахаридов Фруктоза, манноза, галактоза вовлекаются в гликолиз следующим образом. D-фруктоза и D-манноза фосфор или р уются с помощью неспецифнческой гексо- кнназы с образованием соответственно фруктозо-6-фосфата и маниозо-6-фос- фата. Фруктозо-6-фосфат является метаболитом гликолиза. Маннозо-6-фос- фат изомернзуется фосфоманнозоизомеразой во фруктозо-6-фосфат.
Имеется и другой путь включения фруктбзы в гликолиз. Она фосфорн- £ лируется с помощью фруктокиназы печени с образованием фруктозо-1-фосфа- та, который далее расщепляется фруктозо-1-фосфат-альдолазой на д'игид- роксиацетонфосфат и глицеральдегнд. -.
Галактоза сначала также фосфор и лируется в печени с помощью галак- токиназы:»
D-Галактоза + АТФ—*-0-Галактозо-1 -фосфат + АДФ
| - Глюкозо-[-фосфат |
| Глюиш» |
Далее галактозо-1-фосфат превращается в глюкозо-1-фосфат. Для этой реакции изомеризации необходимы уридиндифосфатглюкоза (УДФ-глюкоза) и фермент галактозо-1-фосфат-уридилтрансфероза:
)-1-фосфат + УДФ-глюкоза—
Глюкозо-1 -фосфат подключается к гликолизу уже известным путем, а УДФ- галактоза превращается в УДФ-глюкозу с помощью УЛФ-глюкозоэпимеразы.
4. Спиртовое брожение
Этот путь сбраживания углеводов отличается от гликолиза на стадии дальнейшего превращения пирувата:
Глюкоза
| Пируват Тирумтлеыр- |
| бое L-H; Г |
L
Ацетальдегид
| ^НАД-Н+Н* |
| Ацетат + KoASH + АТФ - |
-над-и+н* •-над + Этанол •
Спиртовое брожение характерно для дрожжей и некоторых микроорганизмов. В тканях человека вместо пируватдекарбоксилазы имеется пируватдегидро- геназный комплекс, окисляющий пируват до ацетил-КоА, а не декарбокснли- рующий его до ацетальдегид а, как пируватдекарбоксилаза дрожжей. Поэтому в тканях животных и человека этанол может образоваться только как побочный продукт (эндогенный этанол). Алкогольдегидрогеназа, имеющаяся в тканях человека (особенно в печени), окисляет этанол до ацетальдегида (другие спирты с меньшей скоростью тоже окисляются до альдегидов), который вовлекается в обмен с помощью альдегиддегидрогеназы:
Ацетальдегид
и ад ь+h нал'
Ацетат включается в цикл Кребса после активирования:
Апетнл ~ SKoA + АМФ+ Н4Р, 0,
5. Переключение анаэробного гликолиза на аэробный
В физиологических условиях ткани организма снабжаются кислородом, поэтому гликолиз является лишь необходимым начальным звеном превращения углеводов. Только в так называемых быстрых («белых») скелетных мышцах, способных к кратковременной интенсивной работе, например при беге на спринтерские дистанции, гликолиз является главным источником энергии для их сокращения. Возможны две ситуации, при которых гликолиз переключается на аэробный путь превращения. Первая связана с предварительным анаэробным распадом углеводов н накоплением лактата. Такая ситуация возникает при кратковременном кислородном голодании отдельных органов или всего организма или при интенсивной работе тех же скелетных мышц, после чего возобновляется нормальное снабжение кислородом н продукт брожения — лактат — сгорает до С02 и Н20. Превращение лактата в пируват возможно, если происходит одновременное окисление НАД • Н2.
Второй вариант переключения наблюдается в тканях с активным снабжением их кислородом. В этом случае образующийся в гликолизе пируват почти не восстанавливается в лактат, а сразу поступает в митохондрии, где окисляется с участием кислорода. Наиболее важным при аэробном пути превращения углеводов является окисление гликолитнческого НАД • Н2 кислородом, а не использование его в реакции восстановления пирувата.
Окисление внемнтохондряального НАД • Н2
НАД • Н2, образующийся в цитоплазме, например при распаде углеводов, не проникает через мембрану митохондрий и поэтому не может непосредственно использоваться для окисления кислородом и образования энергии. Транспорт водорода между внемитохондриальным и внутримнтохондриальным пространствами осуществляется с помощью так" называемых челночных систем. -Схема их работы показана на рис. 40. Существует несколько таких систем «собирания» водорода цитоплазмы и переноса его в виде метаболитов через внутреннюю мембрану митохондрий. Наиболее важным из них является малатаспартатный челночный цикл (рнс. 40, /). Он функционирует следующим образом. Водород НАД• Н2 цитоплазмы «собирается» оксалоацетатЬм, который восстанавливается в малат с помощью изоферментов малатдегид- рогеназы цитоплазмы. Малат является восстановительным.эквивалентом НАД-Н*
Малат проникает через митохондриальную мембрану с помощью переносчика, обмениваясь с 2-оксоглутаратом, который выходит из митохондрий в цитоплазму, т.е. наблюдается антипорт малата и 2-оксоглутарата. В митохондриях малат отдает водород внутримитохондриальному НАД+ с помощью малатдегидрогеназы. Образовавшийся оксалоацетат не проникает через мембрану митохондрий. Его транспОртной формой ^является аспартат, который образуется в митохондриях при переаминнровании оксалоацетата с глута- матом. Аспартат путем антипорта с глутаматом переходит в цитоплазму, где превращается в оксалоацетат, и цикл замыкается. В результате челночных перемещений метаболитов этого цикла за'один такт переносится Пара атомов водорода нз цитоплазмы в митохондрии. В принципе возможен и обратный
Рис. 40 Схема окисления ввемитохондриальиого НАД • Н с помошыо «челночных»
ход этого челночного цикла — с переносом водорода из митохондрий в цитоплазму.
Возможен перенос водорода НАД • Н2 цитоплазмы в митохондрии в составе лактата — лактатный челночный цикл (рис. 40, //). Этот путь окисления внем ито хонд риал ьного НАД - Нг активен в сердце. Малат-аспартат- ный и лактатный механизмы транспорта водорода позволяют использовать цитоплазм этический НАД-Н2 для образования энергии в дыхательной цепи.
Третий путь транспорта водорода назван глицерофосфатным челночным циклом (рис. 40, III). Он активно функционирует в летательных мышцах насекомых. В клетках человека и животных этот цикл доставки внемитохондрналь- ного водорода внутрь митохондрий мало активен. К тому же ФАД • Н2, образующийся в митохондриях при дегидрировании а-глицеролфосфата с помощью ФАД-зависимой а-глицеролфосфатдегидрогеназы, используется не для образования энергии в дыхательной цепи, а окисляется путем свободного окисления. Освобождающаяся тепловая энергия позволяет избежать наступления равыоёесия реакций а-глнцерофосфатного челночного цикла и создает тем самым условия для его непрерывной работы.
ГлицерофосфатныЙ цикл является невыгодным каналом поступления инемитохондрнального водорода, так как не ведет к образованию АТФ в дыхательной цепи. Он оказывается полезным, если требуется теплота, например, для терморегуляции организма. Поэтому глицерофосфатный цикл называют «калоригенным», т.е. продуцирующим теплоту. '

| -3-фосфат 2НАД Н-Н4 - |
| Рис. 41. Энергетический баланс аэробного превра- |
Энергетическая ценность аэробного превращения углеводов
Выход энергии при аэробном превращении составляет 38 молекул АТФ на одну молекулу расщепленной глюкозы (рис. 41) в том случае, если водород НАД ♦ Нг цитоплазмы доставляется к дыхательной цепи с помощью малат-аспар- татного цикла (или, возможно, лактатного). Если водород НАД • Н2 переносится глицеро- фосфатным циклом, то энергия шести молекул АТФ теряется в виде теплоты, и чистый выход энергии составляет 32 молекулы АТФ на 1 молекулу расщепленной глюкозы.
Гликолиз дает две молекулы АТФ, а аэробный распад 38 (или 32) молекул. Это доказывает, насколько ценнее для энергетики клетки аэробный гликолиз. Чтобы произвести столько же энергии анаэробным путем, нужно потратить в 19 (или 16) раз больше глюкозы', чем в присутствии кислорода. Да к тому же образуется метаболический «шлак» —лактат.
| ■ 65(55) %. |
Эффективность аэробного распада глюкозы можно рассчитать так. При полном окислении глюкозы до СОг и Н20 освобождается 2861 кДж/моль. В физиологических условиях для образования-АТФ требуется 45—50 кДж/моль. Следовательно, для образования 38 (32) молей АТФ при аэробном распаде глюкозы требуется 19 000 (16 000) хДж энергии, т.е. энергетическая эффективность аэробного гликолиза составляет
19000(16 000) • 100%
дыханием гликолиза, т. е. в присутствии кислорода прекращается брожение углеводов. Механизм пастеровского эффекта (несмотря на открытие егс в 1876 г.) еще неясен. Его объясняют наличием конкуренции между дыханием и гликолизом за неорганический фосфат (Ф„> и АДФ. Дыхание приводит к снижению Фи и АДФ — необходимых субстратов и активаторов ферменте» гликолиза, и повышает содержание АТФ. АТФ как аллостерическнй эффектор фосфофруктокиназы угнетает ее, что приводит к накоплению глюкозо-6-фос- фата из фрухтозо-6-фосфата.
Глюкозо-6-фосфат инактивирует гексокиназу, что прекращает усвоение глюкозы в клетках.
Эффект Кребтри, или обратный пастеровский эффект, состоит в торможении дыхания избытком глюкозы. Правда, сначала он был показан для опухолевых клеток, а затем н для некоторых нормальных клеток. Механизм эффекта Кребтри, очевидно, тоже связан с конкуренцией за Ф„ н АДФ. Избыток глюкозы, которая является своего рода «ловушкой» для фосфата, приводит к повышению АДФ в цитоплазме и позволяет гликолитическим ферментам'более эффективно конкурировать за АДФ с дыханием.
В опухолях координация дыхания и гликолиза нарушена. В них оба процесса разобщены: ^ктивеи и гликолиз, ведущий к образованию лактата, и дыхание.