
Главная страница Случайная страница
КАТЕГОРИИ:
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Механизм сопряжения дыхания и фосфорилирования в митохондриях 1 страница
|
|
окисления и фосфорилирования, заслуживают внимания химическая, меха- нохимическая и хемиосмотическая.
Химическая гипотеза объясняла образование АТФ в ходе окислительных реакций в дыхательной цепи подобно тому, как это имеет место при субстратном фосфорилировании (при брожении и в цикле Кребса). По этой гипотезе энергия переноса электронов первоначально аккумулируется в виде нефосфорилированиого богатого энергией интермедиата типа X~Y. Затем происходит фосфоролиз этого иитермедната с образованием Х~Р03Нг и. наконец, перенос фосфатной группы на АДФ, т е. синтез АТФ. Эта гипотеза не могла объяснить многих фактов, В частности, почему без мембраны, т. е. в водной среде, перенос электронов по дыхательной цепи не сопровождается фосфорилиронаиием. Не были обнаружены и гипотетические иктермедиаты, богатые энергией.
Механохимическая, или конфоряанионная, гипотеза объясняла механизм сопряжения переходом конформационной энергии от дыхательного переносчика, принимающего при переносе электронов напряженную конформацию («сокращение»), к особому белку АТФ-синтетаэе. расслабление которого ведет к образованию АТФ. Такие циклы ссопращенне — расслабление! тпеханизме окислительного фосфорилирования напоминают работу мышцы. Поиск сократительных элементов, трансформирующих энергию в митохондриях, также не увенчался успехом.
Химическая и конформациоиная гипотезы сейчас имеют лишь исторический интерес. Принципиально новый механизм сопряжения дыхания и фосфорилирования был разработан английским биохимиком Митчелом (196!), гипотеза которого получила название хемиосмотической или протондви- жущей.
По мнению Митчела, энергия переноса электронов и протонов вдоль дыхательной цепи первоначально сосредоточивается в виде протонного потенциала, или электрохимического градиента ионов Н+, создающегося движением через мембрану заряженных протонов. Диффузия протонов обратно через мембрану сопряжена с фосфорилированием, которое осуществляется Н+-АТФ-синтетазой. Дыхание совершает осмотическую работу (концентрирует протоны во внешней среде митохондрий) и электрическую (создает разность электрических потенциалов), которая используется АТФ-сннтетазой на химическую работу, т. е. синтез АТФ. Сочетание этих двух функций дыхания и фосфорилирования дало основание назвать гипотезу хемиосмотической или протондвижущей, поскольку движущей силой фосфорилирования является протонный потенциал.
Протонный потенциал, или электрохимический градиент ионов Н+, обозначается Дцц+(дельта мю Н+) и состоит, как уже было сказано, из двух компонентов: осмотического — разности концентраций ионов Н+, и электрического — разности электрических потенциалов. Разность концентраций ионов Н+, измеряемая в единицах рН, обозначается ДрН. Разность электрн- ческих потенциалов обозначается символом Дф (дельта пси). Следовательно,
Дц„+ = Дф + ДрН.
Синтез одной молекулы АТФ из АДФ и фосфата сопровождается проникновением двух протонов из внешней среды внутрь митохондрий. Разность концентраций ионов Н+ выравнивается, и происходит разрядка мембраны (исчезает электрический потенциал).
Хемиосмотнческая схема Митчела не требует каких-либо высокоэнергетических посредников между дыханием и фосфорилированием._Общим продуктом для двух процессов является протонный потенциал Дцн+. Нарушение структурной целостности мем? 5ряны или повышение ее проницаемости для протонов делает невозможным образование протонного потенциала, что вызывает разобщение между- дыханием и фосфорид нрованием.
Механизм образования протонного потенциала (Дцн+) в дыхательной цепи митохондрий. Перенос протонов и электронов от НАД-Н2 (или ФАД-На) к кислороду должен, согласно хемиосмотической концепции, сопровождаться образованием протонного потенциала. Расчеты показывают, что дыхательная цепь митохондрий создает протонный потенциал в 0, 25 В (из'которого примерно 0, 2 — 0, 22 В падает на Дф и 0, 03 — 0, 05 В на ДрН). Этого вполне достаточно для образования одной молекулы АТФ при условии, что для ее синтеза требуется перенос двух протонов из внешней среды внутрь митохондрий. Следовательно, перенос каждой пары электронов от НАД • Н2 к кислороду при дыхании должен повлечь за собой переход на внешнюю сторону митохон- дриальной мембраны не менее трех пар протонов, а-при окислении ФАД • Hi кислородом — не менее двух пар протонов, т. е. по два протона на каждое звено сопряжения.
Разделение водорода на протоны и электроны напоминает работу переправы с помощью двух разных типов транспортных средств. С помощью одного вида транспорта перевозятся оба груза (т. е. протоны и электроны), а обратно возвращается другим видом транспорта только один из грузов (электроны). В результате на разных сторонах переправы скапливаются разные грузы (на одной протоны, на другой электроны). Поэтому в дыхательной цепи переносчики водорода чередуются с переносчиками только электронов. В трех местах дыхательной цепн переправляется водород с внутренней стороны мембраны на внешнюю, где остается каждый раз по паре протонов, и возвращается пара электронов обратно к внутренней стороне. Следовательно, дыхательная цепь имеет три обратные электронные петли (рис. 37).
Первый перекрест наблюдается на участке от НАД • Н8 до KoQ. На внутренней поверхности мембраны окисление НАД • На с участием.флавинзависимой дегидрогеназы (ФП,) приводит к обрвзованию ФМН • Н2, который переносит водород на внешнюю сторону мембраны. Здесь высвобождается первая пара протонов, а два электрона от ФМН • На пересекают мембрану в обратном направлении (к внутренней стороне), как бы образуя первую электронную петлю. Эти два электрона транспортируются через желе- зосерный белок-1 (FeS-nPj) н один из цитохромов b (6Ma) к KoQ. Восстановление KoQ сопровождается последовательным связыванием двух протонов из матрикса и образованием KoQ • Н2.
Второй перекрест происходит на участке от KoQ * Н5 до цитохро-
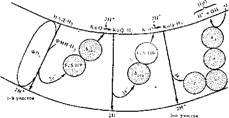 Рис. 37. Схема образонання протонного потенциала а ходе дыхания (показаны предполагаемые участки перекреста' мембраны)
Рис. 37. Схема образонання протонного потенциала а ходе дыхания (показаны предполагаемые участки перекреста' мембраны)
|
ма С|. Транспорт водорода на внешнюю сторону мембраны н окисление KoQ • Н2 на этом участке осуществляется в ходе так называемого Q-цикла, детали которого еще не ясны. Водород в составе KoQ • Н2 переносится с внутренней стороны на внешнюю с помощью специальных Q-белков. На внешней поверхности окисление KoQ • Н2 сопровождается переходом второй пары протонов в среду и возвращением (вторая электронная петля) двух электронов через цитохром Ьш и железосерный белок-2 (FeS-ПР,..) к другой молекуле KoQ, которая при восстановлении захватывает еще два протона из ма- трнкса.
Третий перекрест начинается, когда KoQ • Н2 вновь переносит водород наружу, где окисляется, освобождая третью пару протонов. Два электрона от KoQ • Н2 через цитохромы с, и с передаются с внешней стороны на цитохромы а и as (цитохромоксидазу), которые расположены поперек мембраны, — третья электронная петля.
Цнтохромоксидаза — единственный из переносчиков дыхательной цепи, связывающий 02. На цитохроме а3, обращенном к матриксу, происходит восстановление кислорода по уравнению
2е- + 7s02 + 2Н+ — Н, 0 или 4е~ +02-МН+— 2НаО
Ионы Н+ для образования гидроксильных ионов и молекулы воды берутся из матрнкса митохондрий.
Окисление НАД • На, начавшись на внутренней поверхности, заканчивается после трехкратного пересечения мембраны протонами и электронами восстановлением кислорода и образованием воды тоже на внутренней поверхности • внутренней мембраны митохондрий. Источником шести Н" *", освобождающихся снаружи митохондрий, служат два Н+ от субстратов окисления (находящихся в составе НАД • Нг)к четыре Н+ из среды матрикса. Источниками электронов, использующимися для восстановления кислорода, являются
|
только НАД • Нг или ФАД • Нг, образующиеся при дегидрировании субстратов.
Соотношение протоиы/электроны при дыхании равно 2Н+/е~, т. е. на два освобождающихся протона в среду переносится один электрон. В последнее время получены данные, что это соотношение, возможно, выше, например 4Н+/е~. В частности, выявлено необычное свойство цитохромоксидазы не только восстанавливать кислород, но н «откачивать» во внешнюю среду протоны (цнтохромоксндазныЙ генератор протонов). Возникающий протонный потенциал используется в процессе фосфорилирования.
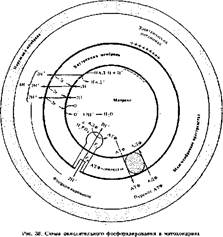
Механизм фосфорилирования. Синтез АТФ, сопряженный с обратной диффузией протоков через мембрану, осуществляется Н+-АТФ-сннтетазой (рис. 38). Внешне она имеет грибовидную форму и состоит из двух структур-' ных частей. «Ножка гриба» в виде белкового цилиндра пронизывает всю толщу внутренней мембраны митохондрий. Один торец цилиндра сообщается с внешней средой, а второй на границе внутренней поверхности мембраны прикреплен к шаровидной головке. Эти головкн выступают в матрикс митохондрий. Цилиндрическая часть обозначается «Fo», а шаровидная («грибовидные выросты») — «Fj». Значит, Н+-АТФ-синтетазу можно представить как «Fo-f- + F|>. Многочисленные «грибовидные выросты», которыми усеяна внутренняя мембрана на электронограммах митохондрий, являются Fi-субчастицами АТФ-синтетаэы.
Строение, свойства и функция этих двух частей фермента совершенно разные. Общая масса F0+Fi примерно 500 тыс. дальтон, из них иа Fi приходится около 340 тыс., а на F0 остальная масса. F0 — сильно гидрофобный белок, состоящий из четырех полипептидных цепей. F| состоит из десяти поли- пепткдкых цепей пяти разных типов (по две каждого тила). Они обозначаю-: - ся как а, f$, у и б. Соединяется Fi с F0 через 6-цели. F0 выполняет функцию канала в мембране, через который просачиваются протоны, a Fi — фосфори- лирующую функцию. Если «срезать» головки (F|), то прекращается синтез АТФ из АДФ и фосфата н через канал легко проходят протоны по градиенту. Добавление Fi «запечатывает» протонный канал и восстанавливает способность к синтезу АТФ, сопряженному с дыханием. Следовательно, через Fo доставляются протоны к активному центру F|, где происходит синтез АТФ.
В каталитическом центре фермента электрическое поле, создаваемое дыханием, смещает равновесие системы
АДФ3- + POJ- + 2Н+ АТФ[3]
в сторону синтеза АТФ. Синтезированная АТФ переходит в матрикс. Перенос АТФ наружу осуществляется специальным транспортным белком мембраны митохондрий, который обменивает АТФ на внешний АДФ, нужный для фосфорилирования (см. рнс. 38).
Катализируя обратную реакцию, Н+-АТФ-синтетаза работает как Н+- АТФаза (протонная аденозинтрифосфатаза), откачивая протоны из внутреннего пространства наружу за счет энергии гидролиза АТФ. АТФазный генератор протонного потенциала может работать до тех пор, пока значение потенциала не уравняется со значением энергии, освобождаемой при гидролизе АТФ. В естественных условиях, когда роль генератора протонного потенциала выполняет дыхание, АЛ^Ф-синтетазе труднее работать против электрического поля, расщепляя А" РФ, чем синтезировать АТФ, используя энергию протонного Потенциала. Наблюдается дыхательное фосфорилированиё. Торможение дыхания вынуждает АТФ-синтетазу растрачивать энергию АТФ на откачивание протонов из внутреннего отсека наружу. Возможно и обращение окислительно-восстановительных реакций (потока электронов и протонов) в дыхательной цепи за счет энергии протонного потенциала. В этом случае происходит восстановление переносчиков дыхательной цепи.
Все известные биологические трансформаторы энергии: внутренняя мембрана митохондрий, мембрана тилактоидов хлоропластов растений, хромато- форов фотосинтезируюших бактерий и клеточная мембрана аэробных бактерий— работают по типу протонного цикла. Их работа напоминает работу молекулярных электростанций, источником энергии для которых служат органические субстраты или кванты света.
Нефосфор ил нру ю шее окисление в дыхательной цепи как механизм образования теплоты в митохондриях
В митохондриях не всегда дыхание сопряжено с фосфорилированием. Такой путь окисления субстратов в дыхательной цепи был назван Ленинджером нефосфорилирующим или свободным окислением. При нефосфор ил ирующем окислении дыхание отключено от фосфорилироваиия и дыхательная цепь работает как бы на «холостом» ходу, так как вся энергия окисляемых веществ превращается в теплоту, не используемую для выполнения клеточных функций. Митохондрии, в которых идет нефосфор ил и рующее окисление, становятся своеобразной клеточной «печкой», производящей теплоту. Это необходимо в тех ситуациях, когда потребность в теплоте для тканей организма больше, чем в АТФ. Например, для поддержания температуры тела при охлаждении теплокровных организмов.
Теплообраэующая функция митохондрий была впервые продемонстрирована В. П. Скулачевым в экспериментах на голубях, подвергавшихся многократному охлаждению при минусовой температуре. Холод у них вызывал разобщение дыхания и фосфорилироваиия в митохондриях мышечной тканн. Избыточное образование теплоты в митохондриях препятствовало замерзанию организма/ Впоследствии терморегулирующая функция мышечных митохондрий была обнаружена у морских котиков при естественных колебаниях температуры окружающей среды.
Для мышечных митохондрий производство теплоты — не основная функция. В организме имеется ткань — бурый жир, митохондрии которого специализированы на выработке теплоты. Бурого жира много у новорожденных; с возрастом у человека его количество убывает. Особенно много бурого жира у зимоспящих животных, чутко реагирующих на температуру окружающей среды. Необычная для жира коричневатая окраска его объясняется большим содержанием митохондрий. Эти митохондрии отличаются от остальных тем, что в них примерно в 10 раз больше ферментов дыхания, чем фосфорилироваиия, т. е. они в меньшей степени настроены на производство АТФ, чем на свободное дыхание. Разобщение дыхайия и фосфорилироваиия в митохондриях бурого жира ведет к образованию большого количества теплоты, согревающей протекающую кровь.
Разобщителями в митохондриях мышц, бурого ^сира и других тканей являются свободные жирные кислоты, которые повышают проницаемость мембран для протонов и тем самым способствуют переходу энергии протонного потенциала в теплоту. В буром жире легче создается высокая концентрация свободных жирных кислот, чем в других тканиях (где триацилглицеринов сосредоточено значительно меньше), что вызывает более сильное разобщение дыхания и фосфорилироваиия в митохондриях бурого жира и образование в них теплоты.
- Первый тип можно назвать оксидазным. Схематически его можно записать:
s. н, + 7»о» — s + н, о Продуктами реакции данного типа являются окисленный субстрат S и вода. Эти реакции локализованы во внутренней мембране митохондрий (дыхательная цепь), и кислород в них расходуется в конечном счете на образование энергии. Активатором молекулярного кислорода выступает цитохромоксидаза. Второй тип реакций — пероксидазный, протекает по схеме
s • Hj + Ог—s + НА 1
Продуктами реакции являются окисленный субстрат и пероксид аодорода. Этот тип реакции катализируется главным образом аутооксидабельными (самоокисляющимися) флавопротеидами. Водород, отнимаемый от субстрата в этих реакциях, сначала принимается флавиновыми коферментами данного фермента, а затем на поверхности этого жечфермента происходит окисление молекулярного кислорода с образованием НаО'г. Однако некоторые ферменты, использующие кислород на образование НаО: , не являются флавиновыми, а содержат ионы металлов.
Реакции этого типа более широко распространены в растительных клетках, чем в клетках животных и человека.
Наибольшее количество пероксидобразуюших ферментов сосредоточено в специальных органоидах клетки — пероксисомах, где образуется до 80% всего пероксида водорода клетки. Такими ферментами в пероксисомах являются оксид азы D- и L-аминокислот, полиаминоксидаза, оксид аз а L-a-окси- кислот.
Кислород в реакциях второго типа используется на окисление ряда природных соединений (аминокислот, полиамннов, оксикислот, сульфитов, пуринов, альдегидов, биогенных аминов и т. д.). К своеобразным «издержкам» этого пути окислительного распада веществ относится образование токсического для клеток организма пероксида водорода. Однако у этого пути потребления кислорода есть и другая биологическая функция. В лейкоцитах (нёйтро- филах, лимфоцитах, моноцитах), гистиоцитах и других клетках, способных к фагоцитозу, т. е. поглощению микроорганизмов и инородных тел, такой путь синтеза H2Oj очень активен, а образующийся пероксид используется.для обезвреживания болезнетворных бактерий и распада неннфекционного материала, поглощенного клетками.
Третий тип реакций — оксигеназный. Эти реакции катализируются моно- оксигеназами по схеме
А.Нг + S+ O, — A + SO + HjO (где А • Н9 — донор водорода; S — окисляемый субстрат) или диоксигеназа- мн по схеме S + О, — SOs
Монооксигеназный механизм реакций предусматривает включение одного атома кислорода в окисляемый субстрат, а другого — в молекулу воды. Диок- сигеназный приводит к внедрению обоих атомов молекулярного кислорода в окисляемое вещество.
Монооксигеназы существуют или в виде растворимых ферментов, находя- тихся в клеточном сок.е, или в виде специальных цепей окисления, расположенных в мембранах эндоплазматического ретикулума печеночных клеток, митохондрий клеток коры надпочечников и т. д. К растворимым, моиооксиге- назам относятся медьсодержащие монооксигеназы, например дофамин-р- монооксигеназа, участвующая в окислении промежуточных продуктов Аштеза норадреналина и адреналина в хромаффинной ткани; тирозиназа, принимающая участие в окислительном образовании пигмента меланина из тирозина в коже, радужке и сетчатке глаза.
Моноокснгеназяые цепи окисления представляют собой короткие цепи переноса электронов и протонов, источником которых служит преимущественно НАДФ • Н2 (реже НАД» Н2), а активатором 02 — специальный тип цито-

|
Монооксигеназные цепи используются для окисления природных органических веществ в ходе синтеза желчных кислот, стероидных гормонов из холестерина, а также для обезвреживания лекарств и ядов.
Четвертый тип реакций — пероксидное окисление ненасыщенных жирных кислот, протекающее по схеме RH + 02-»-R00H. Продуктами пероксидного окисления ненасыщенных липидов служат гидропероксиды липидов, спирты, альдегиды, кетоны, малоновый днальдегид и другие диальдегнды, эпоксиды. Эти реакции потребления кислорода протекают в мембранах митохондрий, эндоплазматического ретикулума, лизосом и т. д., т. е. там, где имеются неиа- сыщеииые липиды (главным образом фосфолипиды). Очевидно, что физиологическая роль реакций этого типа состоит в регуляции обновления и проницаемости липидов биологических мембран. Активатором пероксидного окисления липидов рлужат свободнорадикальные формы кислорода, образующиеся при одноэлектронном восстановлении его по схеме
FeJ+ Fe3+
02 + е" ^ ■» 67 + HjOJ —он + ОН" + 03
Г
НО]
Кислородные радикалы: 67 — супероксидный; ОН — гидроксильиый; Н02 — пероксидный — очень реакционноспособные молекулы, которые спонтанно ускоряют цепные реакции пероксидного окисления ненасыщенных липндов и реагируют с различными биомолекулами (белки, нуклеиновые кислоты и многие другие), вызывая нарушение Их функции. Если создаются условия для образования свободных радикалов кислорода, то самоускоряющийся процесс пероксидного окисления может полиостью разрушить ненасыщенные липиды биомембран, что вызывает неминуемую гибель клеток. Однако в фагоцитирующих клетках для уничтожения поглощенных микробов и неинфекционного материала используется наряду с Н202 супероксидный радикал. 216
Схему основных путей потребления кислорода в клетках можно выразить следующим образом:
Продукты Функция
—► Н20 Энергетическая
Окислительное превращение ряда ] дорастворнмых в
распад
Поступление кислорода по каждому из этих путей неравноценно и зависит от ряда обстоятельств. Подавляющая часть клеточного фонда кислорода, от 80 до 90%, используется по первому пути в митохондриях, где функционирует система окислительного фосфорилирования. Большая доля оставшегося кислорода расходуется по монооксигеназиому пути (третий путь на схеме), причем главным образом в окислительных цепях эидоплазматической сети клеток печени и других органов и в митохондриях клеток коры надпочечников.
Основной продукт реакций биологического окисления, использующих кислород, — вода. Однако в ходе этих процессов образуются также пероксид водорода, кислородные радикалы и пероксиды липидов, которые в повышенных концентрациях токсичны для клеток организма. Поэтому имеются системы обезвреживания этих продуктов биологического окисления.
Регуляторы свободнораднкальиого окисления в клетках
Для сдерживания процессов свободнорадикального окисления в клетке существуют защитные механизмы. Инактивация радикалов кислорода, которые могут возникнуть в ходе биологических реакций переноса электронов или под влиянием' внешних воздействий (ионизирующее, ультрафиолетовое излучение, ультразвук и т. д.), осуществляется с помощью фермента супероксиддисмута- зы, имеющегося у всех аэробных организмов и защищающего их от токсического действия кислорода. Супероксиддисмутаза осуществляет реакцию дис- пропорционирования свободных радикалов кислорода, которая спонтанно протекает относительно медленно по схеме
6г + 62- + 2Н+ — нгог + о3 Издержками этого ферментативного процесса является образование токсичного пероксида водорода. Активна супероксиддисмутаза в фагоцитирующих клетках, чтобы н них образование супероксидных радикалов для осуществления биологических функций не превысило порог безопасности.
| (1) |
Регуляция пероксидного окисления липидов не менее, важна, чем инактивация свободных радикалов кислорода. Схема цепной реакции пероксидного оксиления липидов имеет вид
RH»- R
[4=1
С возрастом накопление пероксидов липидов ускоряет старение организма. Пероксиды липидов задерживают деление клеток и тем самым снижают процессы заживления поврежденных тканей.
Внешние факторы (ионизирующее и ультрафиолетовое излучение, металлы с переменной валентностью и т. д.) вызывают образование радикалов жирной кислоты (R) и пероксидного радикала (R02) к нарушение функции мембран. Вещества, активирующие пероксидное окисление, называются прооксидан- тами, а обрывающие этот процесс — антиоксидантами. Ниже приведены регуляторы пероксидного окисления липидов в клетках организма (по Ю. А. Владимирову и А. И.Арчакову).
П рооксмд анты
1. Легко с амооки сдающиеся соединения, образующие свободные радикалы — витамины A, D, нафтохиноны
2. Восстановили — НАДФ • Н, липоевая
3. Свобод нора дик ал ьные метаболиты, образуемые действием других прооксндантов
А нтил и лоперохсидакты
Антиоксиданты
1. Истинные антиокснданты токоферольного типа: а-токоферол, тироксин, стероидные гормоны, селен
2. SH-соеднненив
3. Антиокснданты — коыидексоны, связывающие железо
И нактиваторы гидропероксидов
1. Ферментативные системы
2. Вещества, восстанавливающие гидрове- роксиды
В настоящее время синтезированы высокоактивные антиокснданты (например, дибунол), во много раз превышающие эффект классического антиок- снданта а-токоферола.
а-Токоферол, присутствующий в мембранах, является своеобразной химической системой защиты мембран от пероксидного оксиления липидов. Ферментативный механизм, освобождающийся от избытка пероксидов в клетке, осуществляется с помощью глутатионпероксидазы. Схема реакции
ROON + 2r-SH ROH + r-S—S-Г + Н, 0
Восстановленный глутатнон (Г-SH) используется как восстановитель гидропероксидов липидов (ROOH) в этой реакции. Глутатионпероксидаза содержит в качестве кофактора селен. Возможно, с этим связано антиоксидантно£ действие селена.
Распад пероксида водорода в клетках
Обезвреживание НяС^ осуществляется с помощью двух гемсодержащих ферментов — каталазы и пероксидазы. Каталаза присутствует во всех клетках н тканях организма; особенно богаты ею печень, эритроциты, почки. Она состоят из четырех субъединиц, каждая из которых связана с гемом. Катала- за — наиболее «скоростной» фермент. Одна молекула ее разлагает до 40 тыс. молекул Н202 в 1 с. Пероксидаза в животных тканях — малоактивный фермент по сравнению с каталазой. Растительные клетки, напротив, богаты перок- сидазой.
Реакции, катализируемые каталазой и пероксидазой, различны, но в то же время имеют общие черты:
но но о
I + I к" " °.э2> 2НаО+ и
НП но о
но о
н? J п™„Яз„ I!
|+ 5 2HgO + S
НО | II
НО О
В каталазной реакции субстратом и донором водорода служат молекулы пероксида водорода, а в пероксидазной донором водорода является органический субстрат (НО—S—ОН). При низких концентрациях Н202 в клетках и достаточном количестве других органических субстратов (что типично для физиологических условий) каталаза действует как пероксидаза. В частности в пероксисомах клеток, которые богаты каталазой, возможно окисление этанола, пропанола этим ферментом, т. е. каталаза действует как пероксидаза:
н
НО—ОН + СН3-(!: -ОН^" " аз'. 2НоО + сн, —
I хн
н
Возможно, что в животных тканях вообще отсутствует пероксидаза, подобная той, что имеется в растительных тканях, и обезвреживание Н202 осуществляется только каталазой.
ГЛАВА 14. АНАЭРОБНОЕ ОБРАЗОВАНИЕ ЭНЕРГИИ ИЗ УГЛЕВОДОВ
Образование энергии в клетках происходит не только в процессе окислительного фосфорилирования (аэробным путем), но в ходе распада питательных веществ без участия молекулярного кислорода. Такой бескислородный, или анаэробный, путь образования энергии называется брожением. Брожение — более древний и более примитивный способ извлечения энергии, чем аэробный. Он сформировался в примитивных организмах в те времена, когда атмосфера Земли не содержала кислорода. Постепенно доля его в энергетическом обеспечении организмов уменьшалась за счет развития более эффективного аэробного пути образования энергии. Образование энергии путем брожения используется организмами, способными существовать в анаэробных условиях.
К ним относятся облигатные анаэробы (клостридии, метанобразующие и денитрифицирующие бактерии, некоторые низшие беспозвоночные, обитающие глубоко в почве или иле); для них брожение — единственный источник энергии. Факультативные анаэробы (большинство бактерий, дрожжей, червей и т. д.) получают энергию за счет брожения в бескислородной среде; в присутствии молекулярного кислорода они расщепляют питательные вещества анаэробным путем, а продукты брожения окисляются в дыхательной цепи с участием кислорода.
У всех высших растений и животных, в том числе у человека, сохранилось брожение, которое играет как бы двоякую роль. Оно является обязательной начальной стадией расщепления энергетических ресурсов, завершающейся аэробным окисприирм обпячовавтихся промежуточных продуктов, и вспомогательным путем производства энергии.
Главным источником получения энергии анаэробным путем в клетках служат гексозы, прежде всего D-глюкоз.а (некоторые микроорганизмы способны сбраживать пентозы, аминокислоты, жирные кислоты, извлекая при этом энергию). Имеются различные варианты брожения углеводов, отличающиеся друг от друга, главным образом, хонечными продуктами:
Отдельные реакции гликолиза
1. фосфорилирование D-глюкозы. Это первая реакция, которая запускает гликолиз. В ходе этой реакции глюкоза превращается в глюкозо-6-фосфат по уравнению
Реакция катализируется ферментом гексокинаэой и требует АТФ (донор фос- форильных групп) и ионов магния. Гексокииазная реакция практически необратима в физиологических условиях. Гёксокиназа присутствует в клетках организма в виде четырех типов изоферментов (I, II, III и IV), которые обладают разной специфичностью. к субстратам и скоростными возможностями. Гёксокиназа IV (глюкокиназа) отличается высокой специфичностью к глюкозе (Кт для глюкозы равна 2 • Ю-2 М). Поэтому гёксокиназа IV не превращает другие гексозы и работает при высоком содержании глюкозы. Этот фер. мент имеется только в клетках печени н включается в работу по фосфорили - рованию свободной глюкозы, когда в крови воротной вены большая концентрация глюкозы (например, при обильном всасывании ее из кишечника).