
Главная страница Случайная страница
КАТЕГОРИИ:
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Правила роботи з чистими культурами мікроорганізмів
|
|
Чисті культури – це популяція мікроорганізмів одного виду. Їх використовують для дослідження морфологічних, фізіологічних і біохімічних властивостей мікроорганізмів.
Під час роботи з чистою культурою важливо не допустити її забруднення іншими мікроорганізмами. Часто чисті культури мікроорганізмів вирощують на твердих середовищах у пробірках, які закриті ватними корками. Корки перешкоджають проникненню в них мікроорганізмів з повітря. Щоб не заразити чисті культури сторонніми мікроорганізмами, при виготовленні препаратів і пересівах необхідно додержуватися певних правил роботи з ними:
1.Запалити газовий пальник.
2.Пробірку з культурою взяти в ліву руку так, щоб було видно поверхню середовища з нальотом мікроорганізмів і наблизити до полум’я пальника.
3.У праву руку взяти бактеріологічну петлю і прожарити її у верхній частині полум’я пальника. Металеву частину держака повільно пронести через вогонь два-три рази.
4.Не випускаючи петлі, мізинцем і безіменним пальцями правої руки притиснути ватний корок до долоні, витягнути його з пробірки і тримати так, не доторкаючись оточуючих предметів.
5.Край відкритої пробірки пронести через полум’я пальника.
6.Ввести в пробірку стерильну петлю, охолодити її, торкаючись внутрішніх стін пробірки або поверхні агару, а потім взяти петлею невелику кількість мікробної маси.
7.Шийку пробірки і ватний корок одночасно провести через верхню частину полум’я пальника і закрити пробірку корком.
8.Пробірку поставити в штатив, а відібрану петлею мікробну масу використати для виготовлення препарату або посіву.
9.Залишки мікроорганізмів на петлі спалити в полум’ї пальника.
Проведення роботи. Метод Коха. Розплавлене і простерилізоване поживне середовище (МПА, МПЖ, сухий поживний агар тощо) розливають по стерильних чашках Петрі та пробірках для одержання агарових пластинок, прямого і косого агару. Після застигання агару чашки вміщують у термостат догори дном для підсушування на 1 годину.
У кількох чашках Петрі з поживним середовищем обережно при піднімають кришку і на центр агарової пластинки наносять краплину суспензії досліджуваної культури. За допомогою стерильного скляного шпателя або бактеріологічної петлі обережно розтирають краплину по всій поверхні поживного середовища чашки. Не обпалюючи шпатель, протирають ним поверхні ще 2-3-х чашок. На зовнішній стороні для чашок роблять позначки олівцем по склу і ставлять їх у термостат для вирощування протягом 2-7 діб, залежно від швидкості росту культури.
З елективної культури мікробів, які належать до факультативних аеробів та анаеробів, з метою одержання ізольованих колоній, роблять глибинний посів у пробірки зі стовпчиком стерильного агару. Для цього стерильною голкою беруть чистку культуру із колонії, обпалюють край пробірки, і тримаючи її дном догори, голкою роблять прокол до дна пробірки.
Виділення чистої культури з однієї клітини здійснюють крапельним методом Ліндера, використовуючи для цього мікроманіпулятор або мікроселектор Перфільєва. Найчастіше метод Ліндера застосовують при роботі з великими клітинами, наприклад, дріжджами, цвільовими грибами і водоростями. З цією метою елективну культуру розводять доти, поки в краплі середовища не залишаться поодинокі клітини. Після цього на поверхню стерильних накривних скелець сталевим пером наносять крапельки суспензії одержаного розведення і виготовляють мікропрепарати «висяча крапля». Препарати розглядають під мікроскопом і відбирають ті, в яких виявлено тільки по одній клітині. Останні вміщують у вологу камеру і ставлять у термостат. Після 1-2 діб інкубації препарати знову розглядають під мікроскопом і ті з них, в яких спостерігається утворення мікроколоній, обережно переносять з накривного скельця клаптиком стерильного фільтрувального паперу в пробірку зі стерильним поживним середовищем.
Визначення чистоти культури можна водночас проводити різними методами: візуально, мікроскопуванням і пересіванням на поживних середовищах.
При візуальній перевірці найчастіше виявляють характер росту культури на поверхні косого агару в пробірках. Якщо штрих на поверхні є однорідним, то культура вважається чистою. Візуально можна перевіряти чистоту культури і на агарових пластинках у чашках Петрі.
У разі мікроскопування вибирають колонію з однорідним характером росту, чітко ізольовану від інших. З цієї колонії виготовляють фіксований препарат і вивчають його під мікроскопом за допомогою імерсійної системи. Якщо в полі зору всі клітини виявляться морфологічно однорідними, то культура є чистою.
Якщо при посівах на низку поживних середовищ спостерігається однаковий характер росту колоній, то можна вважати, що виділена культура є чистою.
Ідентифікація чистої культури. Після виділення культури і перевірки її чистоти визначають, до якого виду вона належить. При ідентифікації виду беруть до уваги морфологічні, культуральні та фізіолого-біохімічні ознаки бактерій, а у актиноміцетів зважають і на хімічний склад клітинної оболонки.
До морфологічних ознак належать: форма, розміри, взаємне розміщення клітин, здатність до руху і характер розміщення джгутиків, здатність до утворення спор та розміщення їх у клітинах, наявність капсул і включень, фарбування за Грамом. В актиноміцетів до цих ознак відносять також утворення гіф, які галузяться.
Серед культуральних ознак мікроорганізмів розрізняють: характер росту культури на рідких і твердих поживних середовищах (МПА, МПЖ, сусло-агар тощо). На рідких середовищах зазначають вигляд бактерійних плівок (тоненька, товста, складчаста, слизиста, суха), їхній колір, наявність помутніння, утворення осаду (щільний, пластівчастий).
При вивченні колоній на твердих поживних середовищах відмічають такі ознаки: форму, профіль, край, структуру (рис.8), розміри. Форма колоній буває кругляста, овальна, неправильна, ризоїдна, амебоподібна, міцелярна. Розрізняють великі колонії – з діаметром понад 4-5 мм, середні – 2-4 мм, дуже дрібні – менше 1 мм. Великі колонії вимірюють звичайною лінійкою, дрібні і дуже дрібні – окуляр-мікрометром.
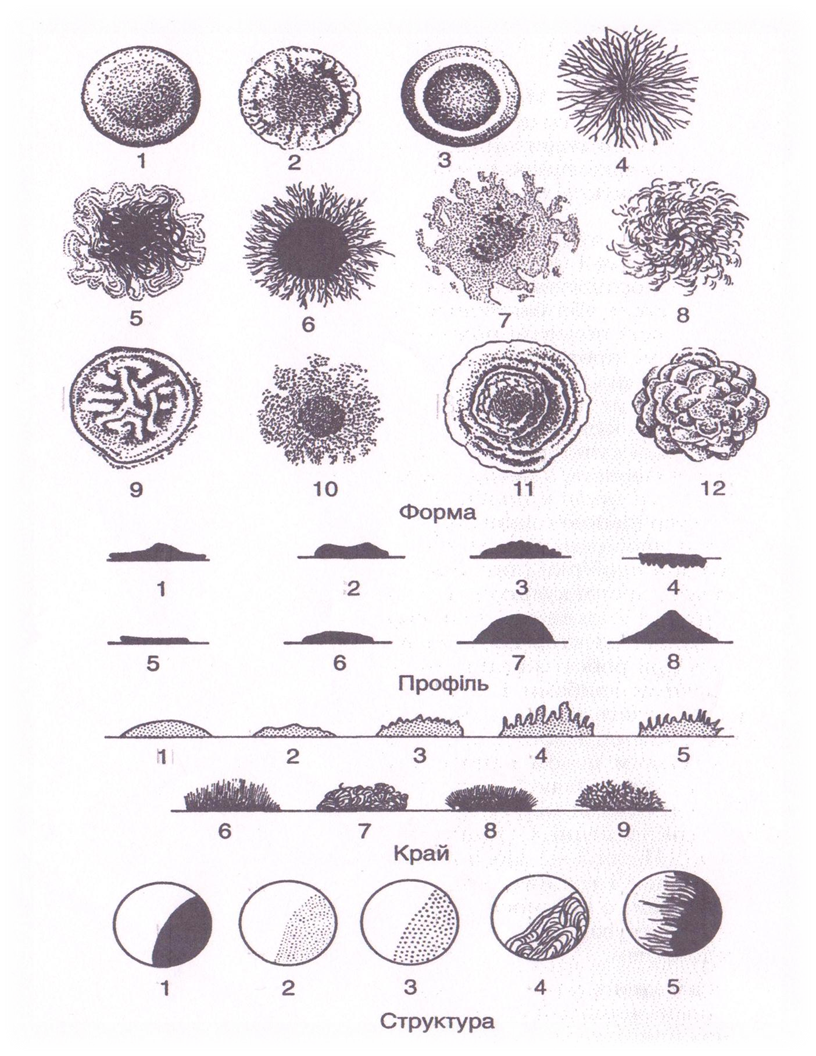
Рисунок 8. Характеристика колоній мікроорганізмів
Форма: 1 – округла; 2 – округла з фестончастим краєм; 3 – округла з валиком; 4, 5 – ризоїдна; 6 – з ризоїдним краєм; 7 – амебоподібна; 8 – ниткоподібна; 9 – складчаста; 10 – неправильна; 11 – концентрична; 12 – складна. Профіль: 1 – зігнутий; 2 – кратероподібний; 3 – горбкуватий; 4 – врослий у субстрат; 5 – плескатий; 6 – опуклий; 7 – краплеподібний; 8 – конусоподібний. Край: 1 – гладенький; 2 – хвилястий; 3 – зубчастий; 4 – лопатевий; 5 – неправильний; 6 – війчастий; 7 – нитчастий; 8 – ворсинчастий; 9 – галузистий. Структура: 1 – однорідна; 2 – дрібнозерниста; 3 – крупнозерниста; 4 – струминчаста; 5 – волокниста.
Поверхня колоній буває гладенькою, зморшкуватою, блискучою, матовою, шорсткою, з концентричними колами тощо. Найкраще її вивчати у відбитому світлі. Край колоній рівний, хвилястий, бахромчастий, зазублений. Колонії можуть мати м’яку, тверду, слизову, волокнисту консистенції. Структура колоній буває однорідною, дрібнозернистою, великозернистою, хвилястою. Край, консистенцію, структуру колоній добре вивчати за допомогою мікроскопа МБС-1. Колір колоній – білий, брудно-білий, жовтий, оранжевий, синій, зелений, червоний, чорний – залежить від наявності в тілі мікробів пігментів. Особливу увагу звертають на колір при вивченні актиноміцетів. До культуральних ознак належать відносять також запах колоній (земляний, ефірний, фруктовий та інші).
Визначення мікроорганізмів за культуральними і морфологічними ознаками. Із колоній, які виросли на твердих поживних середовищах, виготовляють мікропрепарати і вивчають під мікроскопом. За формою клітин і характеристикою колоній, встановлюють, до якого роду належать мікроорганізми. Розглянемо такі роди: Actinomyces, Bacillus, Flavobacteriom, Micrococcus, Pseudomonas, Sarcina.
Рід Actinomyces. Бактерії цього роду переважно є сапрофітами, утворюють щільні шкірясті колонії різної структури (гладенькі, складчасті, горбкуваті з мучним нальотом). Вони можуть бути різних відтінків, зростаються з субстратом, часто складаються з несептованих ниток.
Рід Bacillus. Спороносні паличкоподібні бактерії. Сінна паличка (B. subtilis) утворює на МПА + сусло-агарі сухі дрібнозморшкуваті, безбарвні з хвилястим краєм колонії. Під мікроскопом бактерії мають вигляд коротких рухомих паличок з перетрихальним розміщенням джгутиків. Картопляна паличка (B. mesentericus), як і сінна, утворює на МПА сухі зморшкуваті сірі колонії, а на МПА + сусло-агарі – шкірясто-складчасті.
Клітини картопляної палички прямі, рухливі з центричним розміщенням спор. Грибоподібна паличка (Bacillus mycoides) утворює дуже характерні колонії, які мають плескату ризоїдну або міцелоподібну форму (рис.9).
Вони стеляться по поверхні агару. Клітини цих бактерій рухомі, перетрихи, фарбуються грампозитивно.
Рід Flavobacteriom. Представники цього роду утворюють на МПА дрібні колонії (діаметром 2-3 мм), які переважно бувають гладенькими, прозорими або матовими, жовтого кольору. Клітини мають злегка зігнуту паличкоподібну форму, більшість нерухомі, грам негативні, не утворюють ендоспор.
Рід мікрококи Micrococcus. Утворюють на МПА дрібні та середнього розміру колонії, які можуть бути блискучими, матовими, гладенькими, опуклими або плескатими, зернистими, дрібно складчастими, пастоподібної або слизової консистенції. За кольором вони бувають білими, сірими, рожевими або червоними; трапляються і безбарвні. Клітини нерухомі, неспороносні, грампозитивні.
Рід Pseudomanas. Бактерії цього роду на МПА утворюють колонії круглястої і неправильної форми, плескаті та опуклі, слизової пасто побідної консистенції, безбарвні та забарвлені в синій, синьо-зелений, жовто-зелений, флуоресцуючий, червоний, бруднувато-білий і чорний колір. Клітини мають пряму або зігнуту форму, рухливі, грам негативні, переважно аероби.
Рід Sarcina. Утворюють середні за розмірами колонії круглястої форми, які можуть бути опуклими, плескатими, гладенькими або складчастими, зернистої структури, матові або жирно-блискучі. За кольором бувають жовтими, білими, а подекуди рожевими і червоними. Клітини, як правило, мають кулясту форму і з’єднані в пакетики по 8-16 клітин. Сарцини належать до облігатних аеробів. Це нерухливі, грампозитивні бактерії.
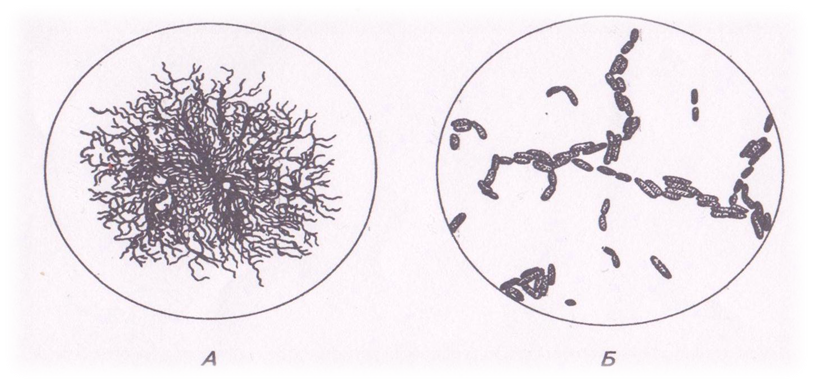
Рисунок 9. Грибоподібна бацила Bacillus mycoides. А – колонія на МПА; Б – клітини молодої культури під мікроскопом.
Вивчення фізіолого-біохімічних ознак мікроорганізмів. включає дослідження ферментної активності мікробів, відношення їх до різних джерел вуглецю і азоту, характер продуктів життєдіяльності, які нагромаджуються в поживних середовищах (гази, кислоти, спирти тощо), а також реагування бактерій на кисень, кислоти, луги та інші фактори довкілля.Ферментну активність виділеної культури визначають за розрідженням желатину при уколі в стовпчик желатину, а також за коагуляцією і пептонізацією молока. Визначають активність амілази, целюлози, сахарози, уреази, нітратредуктази тощо. У актиноміцетів визначають утворення ними антибіотиків.Щоб встановити, які джерела використовуються досліджуваною культурою, виготовляють спеціальне синтетичне поживне середовище і до нього додають 1% вуглецевої сполуки (яку хочуть випробувати). Найчастіше з цією метою застосовують пентози, гексози, дисахариди, полісахариди, солі органічних сполук, спирти, жири тощо.
Для вивчення використання мікроорганізмами джерел азоту в основному мінеральному середовищі замінюють фосфат амонію на фосфат калію, додають 1% глюкози, а як джерело азоту використовують альбумін, пептон, амінокислоти, сечовину, аміачні й нітратні солі. Щоб виявити здатність мікроорганізмів засвоювати молекулярний азот, із поживного середовища виключають всі зв’язані форми азоту.
Відношення до кисню виявляють за допомогою посіву культури методом уколу в пробірки з МПА, МПЖ та ін. Аероби, як правило, розвиваються у верхній частині середовища. Факультативні анаероби – майже по всьому сліду уколу, облігатні анаероби – тільки в нижній частині.
Щоб виявити витривалість мікроорганізмів до кислот та лугів, до поживного середовища додають різні буферні суміші (для підтримання певного pH середовища).
При використанні мікробами сполук вуглецю (вуглеводів) у субстраті як продукти життєдіяльності можуть нагромаджуватись органічні кислоти, спирти, гази тощо, які можна виявити за допомогою різних методів (використанням індикаторів, якісних хімічних реакцій тощо).
Стійкість бактерій до температури найчастіше виявляють при вирощуванні їх у полі термостатах з різною температурою. Стійкість до концентрації солей у середовищі – культивуванням на основних поживних середовищах з добавкою різних концентрацій солей NaCl, Na2SO4.
Питання для самоперевірки
1. Яка культура вважається чистою?
2. Методи визначення чистої культури.
3. Характер росту мікроорганізмів на МПБ.
4. Характер росту мікроорганізмів на щільному живильному середовищі.
5. Техніка визначення видів мікроорганізмів.
6. Які ознаки мікроорганізмів являються фізіолого-біохімічними?