
Главная страница Случайная страница
КАТЕГОРИИ:
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Теоретические основы. Химические реакции происходят во времени и поэтому характеризуются той или иной скоростью
|
|
Химические реакции происходят во времени и поэтому характеризуются той или иной скоростью. Многие химические реакции протекают мгновенно, т.е. превращение одних веществ в другие заканчивается в десятитысячные и миллионные доли секунды. Часто скорость одной и той же химической реакции изменяется в зависимости от условий.
Чтобы судить о скорости химической реакции, надо знать, как изменяется концентрация в определенные промежутки времени. Концентрацию в данном случае выражают числом молей вещества, содержащегося в одном литре раствора. Если в течение промежутка времени (t) концентрации одного из реагирующих веществ уменьшилась от С1 до С2, то средняя скорость реакции за этот промежуток времени была:
V═ 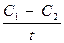
Скорость химических реакций зависит от концентрации участвующих в них веществ, температуры, катализатора, природы реагирующих веществ,
величии поверхности соприкосновения веществ.
Давление влияет на скорость химических реакций не непосредственно, а
через увеличение концентрации реагирующих веществ, находящихся в
газообразном состоянии.
Скорость химической реакции прямо пропорциональна произведению молярных концентраций реагирующих веществ. Этот закон, открытый Гульдбергом и Ваге в 1867 голу получил название закона действующих масс.
Так для реакции: А + В = С
V ═ K[A] · [Β ], где
V – скорость;
К – коэффициент пропорциональности или константа скорости,
[A] и [Β ] – концентрации веществ А и В.
Константа скорости – величина постоянная для данной реакции. Она не зависит от времени и концентрации, а зависит от природы реагирующих веществ и температуры.
Известно, что многие химические процессы значительно ускоряются при повышении температуры, рост которой усиливает скорость движения молекул, увеличивая тем самым число столкновений между ними.
Как правило, в большинстве случаев повышение температуры на 100 скорость увеличивается от двух до четырех раз (правило Вант – Гоффа). Число, характеризующее ускорение реакции при нагревании на 100, называется температурным коэффициентом скорости.
Vt ═ Vt1 · γ 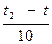 ,
,  где Vt1 – скорость реакции после повышения температуры до t2
где Vt1 – скорость реакции после повышения температуры до t2
Vt – начальная скорость реакции при температуры t1
γ – температурный коэффициент реакции, т.е. число, показывающее, во сколько раз увеличивается скорость реакции при повышении температуры реагирующих веществ на 10 градусов.
В обратимых реакциях, когда скорость прямой реакции равна скорости обратной реакции называется химическим равновесием. Переход из одного состояния равновесие в другое называется смещением химического равновесия. Правило смещения химического равновесия под влиянием давления, температуры и концентрации веществ сформулировал Ле-Шателье (принцип Ле-Шателье): Если на систему, находящуюся в равновесии, произвести внешнее воздействие, то равновесие сместится в сторону, препятствующее этому воздействию.