
Главная страница Случайная страница
КАТЕГОРИИ:
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Наиболее часто применяются диаграммы с координатами pv, pT, vT, Ts, is.
|
|
Относительно функциональной формы уравнения состояния можно отметить, что для каждого вещества характер функциональной связи индивидуален, и термодинамические свойства описываются конкретным для данного вещества уравнением состояния. Вопрос построения уравнения состояния окончательно не решен даже для газов, не говоря уже о жидких и твердых телах.
Теория уравнения состояния пока разработана лишь для идеального газа, для газов, имеющих небольшую плотность, и в меньшей степени для плотных газов.
Уравнение состояния идеального газа впервые было получено Клапейроном в 1834 году путем объединения уравнений законов Бойля-Мариотта и Гей-Люссака - рv/Т =const. Обозначая константу через R, получим
 (2.7)
(2.7)
где R - удельная газовая постоянная, отнесенная к массе газа, равной 1 кг; Дж/(кг·К).
Уравнение (2.7) записано для 1 кг газа.
Для m кг уравнение состояния будет иметь вид
 (2.8)
(2.8)
где V - объем газа, м3.
Газ, состояние которого точно описывается уравнением (2.7), называется идеальным. Многие реальные газы при малых плотностях и при достаточно высоких температурах по своим свойствам приближаются к идеальным. Поэтому для их расчетов может быть применено уравнение (2.7).
Умножая обе части уравнения (2.7) на молекулярный вес µ, получим
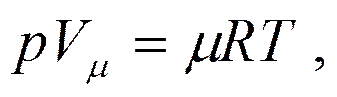 (2.9)
(2.9)
где Vµ = vµ - объем, занимаемый одним молем газа.
Молекулярный вес представляет собой сумму атомных весов атомов, образующих молекулу. Следовательно, молекулярный вес характеризует массу молекулы.