
Главная страница Случайная страница
КАТЕГОРИИ:
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Где А и В - первый и второй вириальные коэффициенты, являющиеся функцией только температуры.
|
|
В настоящее время уравнения подобного вида получили широкое распространение при расчете свойств многих реальных газов. Наиболее простым и качественно верно отображающим изменение состояния реального газа является уравнение Ван-дер-Ваальса, которое является частным случаем общего уравнения состояния Майера - Боголюбова, если пренебречь в правой части всеми членами, содержащими 1/ v во второй степени и выше. Уравнение Ван-дер-Ваальса было получено в 1873 г. и имеет вид

где b - наименьший объем, до которого можно сжать реальный газ. Для каждого газа величина b имеет определенное числовое значение; а - коэффициент пропорциональности, имеющий определенное числовое значение для каждого отдельного газа, не зависящее от параметров состояния.
Уравнение Ван-дер-Ваальса качественно верно отражает состояние реальных веществ в жидком и газообразном состоянии. Для двухфазных состояний оно неприменимо. Для одного моля газа уравнение Ван-дер-Ваальса записывается в виде

Если в уравнении Ван-дер-Ваальса раскрыть скобки и расположить полученные величины по убывающим степеням v, то получим уравнение третьей степени относительно удельного объема газа

Из математики известно, что такое уравнение при заданных значениях р и Т должно иметь три корня. При этом возможны следующие три случая:
1) все три корня различны и действительны;
2) все три корня действительны и равны между собой;
3) один корень действительный и два мнимых (комплексных).
В последнем случае реальное значение имеет лишь один действительный корень, так как мнимые корни не имеют физического смысла.
Если на pv - диаграмме построить изотермы, соответствующие уравнению Ван-дер-Ваальса, то они будут иметь вид кривых, изображенных на рис. 2.3. Анализ этих кривых позволяет заключить, что при сравнительно низких температурах они имеют в средней части волнообразный характер с максимумом и минимумом. При этом чем выше температура, тем короче волнообразная часть изотермы. Изобара АВ, пересекающая изотерму, дает три действительных значения объема в точках А, R и В (три различных действительных корня).
Наибольший корень, равный удельному объему в точке В, относится к парообразному (газообразному) состоянию вещества, а наименьший (в точке А) - к жидкому состоянию. Участок кривой между точками А и В существовать не может, так как уравнение Ван-дер-Ваальса неверно описывает состояние двухфазных систем.

Рис. 2.3
Изотермы, найденные по уравнению Ван-дер-Ваальса
Действительный процесс перехода из жидкого в газообразное состояние изображается прямой линией (изобарой) АВ. При этом точка А соответствует состоянию кипящей жидкости, а точка В - состоянию сухого насыщенного пара.
При некоторой температуре, называемой критической, изотерма не будет иметь волнообразного участка. На этой изотерме есть лишь точка перегиба, касательная к которой должна быть горизонтальной. Это соответствует второму случаю решения уравнения Ван-дер-Ваальса, когда все три корня действительные и равны между собой (точка К на рис. 2.3, 2.3а).
При температурах выше критической изотермы будут иметь монотонно спадающий характер. Здесь будем иметь один действительный корень. Если соединить точки А, А1, А2 и т.д., то получим кривую, на которой жидкость находится в состоянии кипения (пограничная кривая жидкости - кривая АК). Кривая ВК называется пограничной кривой пара. Таким образом, для реального вещества pv - диаграмму можно разбить на три характерные области:
1) область жидкого состояния, расположенную левее кривой АК;
2) область двухфазного состояния (влажного пара), расположенную между кривыми АК и ВК;
3) область перегретого пара, расположенную правее кривой ВК и выше точки К.

Рис. 2.3а
МК – кривая кипящей жидкости;
NK – кривая сухого пара
Условно область жидкости ограничивают сверху линией СК, представляющей собой критическую изобару.
Критическое состояние вещества впервые было открыто Д.И.Менделеевым в 1861г. Критическую температуру он назвал абсолютной температурой кипения, при которой поверхностное натяжение в жидкости становится равным нулю и исчезает различие между жидким и парообразным состоянием вещества. До открытия критического состояния вещества многие газы безуспешно пытались превращать в жидкость одним только увеличением давления. Однако, как это следует из рис. 2.3а, при температурах выше критических жидкое состояние вещества отсутствует. Поэтому для превращения газа в жидкость путем увеличения давления необходимо этот газ охладить до температуры ниже критической. Только после этого сжатием по изотерме любой газ можно превратить в жидкость.
При больших плотностях уравнение Ван-дер-Ваальса дает значительные ошибки, связанные с тем, что при его выводе не учитывались явления силовой ассоциации и диссоциации молекул под влиянием межмолекулярных сил взаимодействия. Кроме того, опытами было доказано, что коэффициенты а и b, входящие в уравнение Ван-дер-Ваальса, описываются достаточно сложными зависимостями от температуры и давления.
Русские ученые М.П.Вукалович и И.И.Новиков в 1939 г. предложили новое универсальное уравнение состояния реального газа, учитывающее явление силовой ассоциации молекул, которое имеет вид
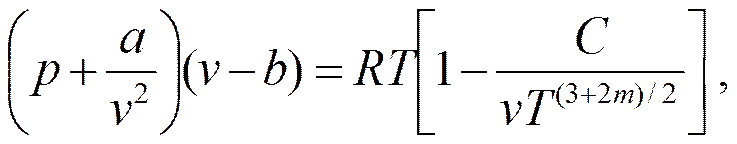
где а и b - постоянные уравнения Ван-дер-Ваальса; С, m - постоянные, определяемые на основе опытов.