
Главная страница Случайная страница
КАТЕГОРИИ:
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Глава 5. Химическая кинетика и катализ
|
|
Химическая кинетика – это раздел физической химии о скоростях и механизмах химических реакций. Она изучает зависимость скорости реакции от строения молекул реагентов, их концентрации, температуры, свойств среды, наличия катализаторов и других причин, определяет последовательность элементарных актов процесса.
Скорость химической реакции
n 1 А 1 + n 2 А 2 = n 3 А 3 + n 4 А 4 (5.1)
определяется изменением концентрации реагентов в единицу времени в единице объема и при постоянном объеме выражается уравнением
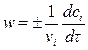 ,
,
где ni и сi – соответственно стехиометрический коэффициент и концентрация i -го реагента в момент времени t.
Скорость реакции всегда положительна. Согласно основному закону химической кинетики (закон действия масс) скорость реакции пропорциональна произведению концентраций реагирующих веществ, взятых в некоторых степенях. Для реакции (5.1), протекающей слева направо,
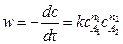 ,
,
где 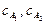 – текущие концентрации реагирующих веществ к моменту времени τ; k – константа скорости; n1, n2 – частные порядки реакции; с – концентрация одного из исходных веществ.
– текущие концентрации реагирующих веществ к моменту времени τ; k – константа скорости; n1, n2 – частные порядки реакции; с – концентрация одного из исходных веществ.
Для элементарных реакций или элементарных стадий сложных реакций каждая из концентраций берется в степени, равной стехиометрическому коэффициенту.
Сумму n = n 1 + n 2 + … – называют общим порядком реакции. Порядки реакции (общие и частные) могут быть целочисленными, дробными, положительными, отрицательными или нулевыми. Их значения задаются механизмом химической реакции – совокупностью элементарных актов взаимодействия, не раскрываемых суммарным уравнением (5.1).
Константа скорости реакции (k) численно равна скорости реакции при условии, что концентрация всех реагирующих веществ равна единице. Константа скорости реакции зависит от природы реагирующих веществ, температуры, катализатора и его концентрации, а также от среды, в которой протекает реакция, и не зависит от концентрации реагентов и времени.
По числу молекул, участвующих в элементарном акте химического превращения, различают реакции мономолекулярные, бимолекулярные и тримолекулярные.