
Главная страница Случайная страница
КАТЕГОРИИ:
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Катализ
|
|
Катализом называется изменение скорости реакции под действием веществ, которые в конце процесса остаются химически неизменными. Такие вещества называются катализаторами.
При увеличении скорости катализ называют положительным, при уменьшении – отрицательным (ингибированием).
Различают два типа каталитических процессов: гомогенный катализ (катализатор и реакционная смесь находятся в одной фазе) и гетерогенный катализ (катализатор находится в виде самостоятельной фазы, и реакция протекает на поверхности этой фазы). Кроме того, выделяют ферментативный катализ, занимающий промежуточное (микрогетерогенное) положение между гомогенным и гетерогенным катализом
Общим для каталитических процессов является то, что катализаторы не изменяют положения равновесия, а лишь ускоряют или замедляют достижение его. Скорость реакции изменяется в результате изменения энергии активации (уменьшения при положительном катализе). При этом в одинаковом направлении изменяется скорость как прямой, так и обратной реакции.
Механизм действия катализатора обычно заключается в образовании промежуточных соединений с одним из участвующих в реакции веществ. Далее это промежуточное соединение реагирует с образованием конечных продуктов и свободного катализатора. Если энергия активации каждой из стадий меньше энергии активации реакции, идущей без катализатора, то процесс ускоряется.
Гомогенный катализ
Простейшая схема гомогенного катализа включает обратимое образование промежуточного комплекса катализатора (К) с одним из реагирующих веществ и превращение этого комплекса в продукты реакции с высвобождением катализатора:
 |
А + К АК
|
 АК + В С + D + К.
АК + В С + D + К.
Применение только к этой схеме (при условии k 2 > > k 1) скорость реакции можно выразить через концентрации реагентов и катализатора:


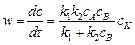 .
.
Это уравнение лежит в основе кинетики гомогенно-каталитических реакций.
Многие гомогенные реакции катализируются кислотами или основаниями. Реакции, катализируемые Н+ или ОН–, относят к специфичному кислотному или основному катализу. Константа скорости кислотно-основного катализа (k) находится в связи с константой диссоциации катализатора (Кд):
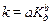
(а и b – коэффициенты, причем 0 < b < 1).
Гетерогенный катализ
В каталитических реакциях, протекающих на поверхностях твердого катализатора, можно выделить пять основных стадий:
1) диффузия вещества к поверхности катализатора; 2) адсорбция вещества; 3) реакция на поверхности, в адсорбционном слое;
4) десорбция продуктов с поверхности; 5) диффузия продуктов реакции с поверхности в объем. Общая скорость каталитической реакции определяется скоростью самой медленной из этих стадий.
Если не рассматривать диффузию и считать, что равновесие адсорбция – десорбция устанавливается быстро, то скорость каталитической реакции определяется скоростью реакции в адсорбционном слое, где роль реагента играют свободные адсорбционные центры. Простейший механизм гетерогенного катализа описывается схемой:

 S(газ) S(адс) Р(адс).
S(газ) S(адс) Р(адс).
Важным свойством катализаторов является избирательность их действия. Это означает, что для одних и тех же исходных веществ данный катализатор увеличивает скорость только одной из возможных реакций и не влияет на скорость других реакций. Большое значение для активности катализатора имеют свойства поверхности, в частности величина ее площади, химический состав поверхностного слоя, его структура.
Ферментативный катализ
Каталитические реакции, протекающие под действием полимерных веществ белковой природы – ферментов, имеют исключительное значение в биологических реакциях.
|
|
|
 E + S ES E + P
E + S ES E + P
Используют уравнение Михаэлиса-Ментен
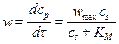 ,
,
полученное методом стационарных концентраций, при условии, что реакция имеет первый порядок по ферменту. Физический смысл величины w max заключается в том, что при больших концентрациях исходного вещества весь катализатор входит в состав промежуточного соединения и концентрация достигает предельного значения сЕ, 0, следовательно и скорость достигает максимального значения: w max = k 3 сЕ, 0. Величина КМ = (k2 + k3)/ k1 называется константой Михаэлиса и может быть определена как концентрация исходного вещества, при которой скорость составляет половину максимальной.
Лабораторная работа № 19