
Главная страница Случайная страница
КАТЕГОРИИ:
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
В щелочной среде
|
|
Цель работы: экспериментальное определение константы скорости реакции гидролиза этилацетата в щелочной среде.
Реактивы: этилацетат, раствор HCl концентрацией
0, 1 моль/дм3, раствор NaOH концентрацией 0, 1 моль/дм3, индикатор фенолфталеин.
Теоретические сведения
Щелочной гидролиз сложных эфиров – бимолекулярная реакция. Механизм этой реакции следующий:
 | |||||||
 | |||||||
| |||||||
| |||||||
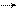
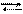
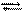


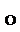 СН3 –С–О–С2Н5 + ОН– СН3 –С–С2Н5 [СН3 –С + С2Н5О–]
СН3 –С–О–С2Н5 + ОН– СН3 –С–С2Н5 [СН3 –С + С2Н5О–]
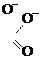 |
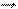 СН3 –С + С2Н5ОН (5.22)
СН3 –С + С2Н5ОН (5.22)
Щелочной гидролиз необратим из-за необратимости
стадии (б). Такой реакции отвечает случай А + В ® продукты, кинетически подчиняющийся уравнениям (5.7) и (5.8).
Количество вступившего в реакцию эфира пропорционально убыли ионов ОН –, которое, в свою очередь, пропорционально расходу кислоты на титрование пробы реакционной смеси.
С учетом сказанного уравнение (5.8) запишется:
 (5.23)
(5.23)
Порядок выполнения работы
1. В колбу вместимостью 100 см3 налить 50 см3
раствора NaOH концентрацией 0, 1 моль/дм3, присоединить ее к обратному холодильнику и поставить в термостат, температура которого задается преподавателем. Если опыт проводится при комнатной температуре (20±5) °С, колбу закрыть пробкой и оставить на лабораторном столе.
В другую колбу налить 50 см3 раствора NaOH концентрацией 0, 5 моль/дм3 и 2 см3 этилацетата. Колбу с реакционной смесью присоединить к обратному холодильнику и поместить в термостат на 1, 5-2 ч при температуре 60-70 °С.
2. Через 10-15 мин в первую колбу добавить 2 см3 этилацетата, отметить время начала реакции, быстро перемешать содержимое колбы и отобрать 2 см3 реакционной смеси для анализа. Колбу с реакционной смесью возвратить в термостат. Пробу влить в колбу для титрования с 10-15 см3 холодной дистиллированной воды и титровать раствором HCl концентрацией 0, 1 моль/дм3 в присутствии фенолфталеина до исчезновения розовой окраски. Объем кислоты, пошедшей на титрование самой первой пробы – V 0.
Количество и интервал отбора последующих проб задаются преподавателем. Последней титровать пробу реакционной смеси, выдержанной при заданной температуре в течение 1, 5-2 ч. Объем кислоты, пошедшей на титрование этой пробы – V ¥ .
Обработка опытных данных
1. Рассчитать по уравнению (5.21) константу скорости для каждой экспериментальной пробы. Найти среднее значение константы скорости, записать ее размерность.
2. Вычислить энергию активации по уравнению (5.13), используя константы скорости при двух температурах.
Экспериментальные и расчетные данные внести в табл. 5.4
Т а б л и ц а 5.4
| № пробы | Текущее время отбора пробы (по часам) | Время от начала реакции τ, мин | Расход HCl на титрование пробы Vt, см3 | Константа скорости реакции k |
Для графической обработки экспериментальных данных уравнение (5.23) представить в виде
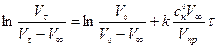 . (5.24)
. (5.24)
Построить график в координатах 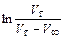 =f (t), и найти константу скорости из тангенса угла наклона прямой (5.24).
=f (t), и найти константу скорости из тангенса угла наклона прямой (5.24).
Контрольные вопросы и задания
1. В чем заключается различие понятий " порядок" и " молекулярность" химической реакции? В каком случае эти величины равны?
2. Доказать, что при переменном объеме скорость реакции не равна производной концентрации по времени. Привести пример изменения концентрации без протекания химической реакции.
3. Доказать, что при переменном объеме скорость реакции не равна производной концентрации по времени. Привести пример изменения концентрации без протекания химической реакции.
4. От каких параметров зависит константа скорости реакции?
5. Существует ли стехиометрическое соотношение между количествами используемого катализатора и исходных веществ? Зависит ли скорость гомогенной химической реакции от концентрации катализатора? Какова ее зависимость?
6. Что понимается под избирательностью действия катализатора? Привести примеры для различных катализаторов в гомогенном и гетерогенном катализе.
7. В каких формах может проявляться каталитическое действие в реакционном процессе?
8. Уравнение скорости химической реакции второго порядка.
Лабораторная работа № 22