
Главная страница Случайная страница
КАТЕГОРИИ:
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Реакция йодирования ацетона протекает по уравнению
|
|
СН3СОСН3 + I2 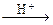 СН3СОСН3I + HI.(5.17)
СН3СОСН3I + HI.(5.17)
Процесс автокаталитический, поскольку ускоряется под влиянием одного из продуктов реакции – ионов водорода. В нейтральном растворе он проходит медленно, но катализируется кислотами.
Реакция протекает в две стадии:
1) обратимая реакция енолизации ацетона
|
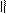
|
 СН3–С–СН3
СН3–С–СН3 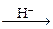 CH3–C=CH2
CH3–C=CH2
2) взаимодействие енольной формы с йодом
CH3-COOH=CH2 + I2 ® CH3COCH2I + HI
Первая стадия протекает значительно медленнее второй, поэтому скорость иодирования в целом определяется скоростью реакции енолизации, для которой уравнение (5.7) примет вид
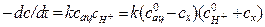 , (5.18)
, (5.18)
или в интегральной форме
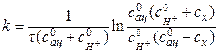 . (5.19)
. (5.19)
В уравнениях (5.18) и (5.19) cац и cН+ – концентрации ацетона и кислоты (моль/дм3) соответственно через время t от начала реакции (мин); 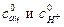 – начальные концентрации соответственно ацетона и кислоты в реакционной смеси (моль/дм3);
– начальные концентрации соответственно ацетона и кислоты в реакционной смеси (моль/дм3);
cх – концентрация ацетона (моль/дм3), подвергшегося превращению за время t (убыль концентрации), которая, согласно уравнению (5.17), равна приращению концентрации HI.