
Главная страница Случайная страница
КАТЕГОРИИ:
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Для односторонних (необратимых) реакций
|
|
В реакциях нулевого порядка скорость реакции от концентрации не зависит:
 или
или 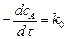 . (5.2)
. (5.2)
Это имеет место в тех случаях, когда убыль вещества в результате протекания химической реакции восполняется доставкой его из другой фазы или, если скорость процесса лимитируется подачей энергии, необходимой для активации реагирующих молекул. Нулевой порядок часто наблюдается в каталитических реакциях, когда скорость определяется концентрацией катализатора и не зависит от концентрации реагирующих веществ.
После интегрирования (5.2) получают
 , (5.3)
, (5.3)
откуда видно, что концентрация реагирующего вещества линейно убывает со временем. Единица измерения константы скорости совпадает с единицей измерения скорости. Подставляя в (5.3)  , определяют время, за которое прореагирует половина исходного вещества,
, определяют время, за которое прореагирует половина исходного вещества,  (период полупревращения):
(период полупревращения):
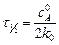 .
.
Реакция первого порядка – А ® продукты.
Скорость реакции
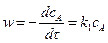 . (5.4)
. (5.4)
Уравнением первого порядка могут описываться скорости мономолекулярных реакций (изомеризация, термическое разложение и др.), а также ряда реакций с более сложным механизмом, например, гидролиза сахарозы с образованием фруктозы и глюкозы. Эта реакция бимолекулярная, однако, из-за наличия большого избытка воды скорость зависит только от концентрации сахарозы.
После интегрирования (5.4) находят
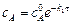 , (5.5)
, (5.5)
где 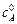 – концентрация вещества А при t = 0.
– концентрация вещества А при t = 0.
Период полупревращения
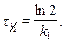
Единица измерения константы скорости реакции первого порядка – с-1.
Реакция второго порядка – 2А ® продукты.
Скорость реакции
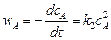 .
.
После интегрирования:
 . (5.6)
. (5.6)
Период полупревращения:
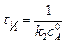 .
.
Единица измерения константы скорости реакции второго порядка – м3/(моль× с).
Реакция второго порядка – А + В ® продукты.
Скорость реакции
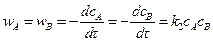 . (5.7)
. (5.7)
После интегрирования
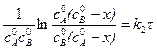 . (5.8)
. (5.8)
Период полупревращения как понятие не определяется.
Единица измерения константы скорости в этом случае – м3/(моль× с).
Реакция n -го порядка: А1 + А2 + А3 … ® продукты.
При 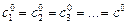 скорость реакции равна
скорость реакции равна
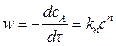 .
.
После интегрирования:
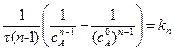 . (5.9)
. (5.9)
Если с=с 0/2, то
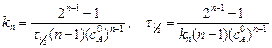 . (5.10)
. (5.10)
Время полупревращения реакции n -го порядка обратно пропорционально начальной концентрации реагентов в степени (n - 1).
Единица измерения константы скорости реакции в этом случае – (моль/м3)1-n× с-1.
Влияние температуры на константу скорости реакции
Скорость большинства гомогенных реакции увеличивается в 2-4 раза при повышении температуры на каждые 10 градусов (правило Вант-Гоффа).
Зависимость константы скорости одностадийной необратимой реакции от температуры описывается уравнением Аррениуса
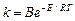 ,
,
где В – постоянная; Е – энергия активации реакции.
В логарифмической форме уравнение Аррениуса имеет вид
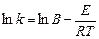 . (5.11)
. (5.11)
Под энергией активации понимают тот избыток энергии по сравнению со средней энергией молекул при данной температуре, которой должны обладать молекулы, чтобы они могли вступить в реакцию. Энергию активации обычно относят к 1 моль вещества. Из уравнения (5.11) следует, что между логарифмом константы скорости реакции и обратной температурой существует линейная зависимость.
В дифференциальной форме уравнение Аррениуса имеет вид
 . (5.12)
. (5.12)
Это соотношение позволяет установить связь между энергиями активации прямой и обратной реакций и изменением
энтальпии (или внутренней энергии). Для этого в уравнении изобары реакции
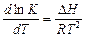
константу равновесия K выражают через отношение констант скоростей прямой k 1и обратной k2 реакций:
 .
.
С учетом (5.12) получают (рис. 5.1):

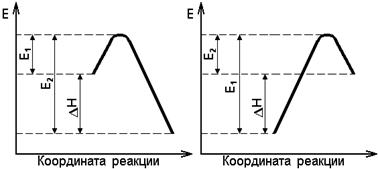
а б
Рис. 5.1. Соотношения между энергиями активации
прямой Е 1 и обратной Е 2 реакций и изменением энтальпии:
а – экзотермическая реакция; б – эндотермическая реакция
Энергия активации может быть рассчитана с использованием графической зависимости (5.11) ln k=f (1/T), по формуле
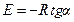 ,
,
где tga – тангенс угла наклона прямой линии.
Для определения энергии активации может быть использовано уравнение:
 , (5.13)
, (5.13)
где k 1 и k 2 – константы скорости при температурах Т 1 и Т 2 соответственно.