
Главная страница Случайная страница
КАТЕГОРИИ:
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Механизм сопряжения дыхания и фосфорилирования в митохондриях 9 страница
|
|
Для транскрипции необходимы определенные условия:
I} участок ДНК. подлежащий трdнскрппш: должен быть pjcri.itTv:! для образования одноцелочечной матрицы (только одна цепь ДНК служит матрицей при синтезе РНК; если бы обе цепи ДНК одновременно использовались в качестве митрииы, то на одном транскр> штоне синтезировались бы две комплементарные РНК, несущие информацию для двух разных белков);
2) наличие рнбонуклеозидтрифосфатип (АТФ, ГТФ. УТФ ЦТФ) дли синтеза РНК;
3) наличие специальных ферментов транскрин пин ДНК-завнсимыч РНК-полимераз, синтезирующих РНК по матрице ДИК.
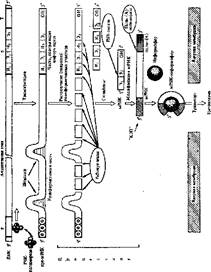
Механизм.транскрипции ДНК. Транскрипция имеет три фазы: инициацию, элонгацию и терминацию, т. е. начало, продолжение и окончание синтеза РНК (рис. 67).
Инициацкя транскрипции происходит вследствие присоединения ДНК-зависимой РНК-полимеразы к промотору, обладающему высоким сродством к этому ферменту. Промотор — стартовая точка транскрипции. РНК-полимераза прокариотов состоит нз пяти разных субъединиц. Четыре из них образуют агрегат, называемый кор-ферментом (от лат. сог — сердце, сердцевина), катализирующий образование фосфодиэфирных связей между нуклеотидами в РНК. Пятая субъединица, называемая о-фактором или о-субъединицей, легко отделяется от кор-фермента. Эта о-субъединица как бы выбирает стартовую точку транскрипции, связываясь с промотором. Затем.к о-фактору, выбравшему место транскрипции, присоединяется кор- фермент. и начинает транскрипцию. Неясно, что вызывает разъединение двойной спирали ДНК в месте транскрипции. Возможно, эту функцию тоже выполняет РНК-полимераза, а может быть, есть специальный белок (типа расплетающего, как при репликации),
У эукариотов имеется три РНК-полимеразы: I, II и III. Это белки, состоящие из нескольких субъединиц и отличающиеся друг от друга по специфичности транскрипции. РНК-Полимераза I ответственна за транскрипцию генов рРНК, РНК-полимераза II —за тРНК и 5S рРНК, а РНК-полимераза III участвует в синтезе предшественника мРНК. Очевидно, структура трех разных типов РНК-полимераз эукариотов предусматривает специфический выбор транскриптонов, содержащих информацию о структуре рРНК, тРНК и полипептидной цепи.
РНК-Полимеразы наращивают цепь всегда только в направлении 5'-»-3'. поэтому 5'-конец содержит всегда трифосфат (Ф~Ф~Ф—), а 3'—свободный ОН. Начинается синтез всех цепей РНК либо о фффА, либо с фффГ, которые
|
специфически спариваются со стартовыми основаниями разных транскрип- тонов.
Элонгация транскрипции происходит при скольжении РНК- полимеразы вдоль матрицы ДНК, Каждый следующий нуклеотид спаривается с комплементарным основанием в ДНК-матрице, а РНК-полнмераза «скрепляет» его с растущей цепью РНК фосфодиэфирными связями. Скорость элонгации составляет примерно 40—50 нуклеотидов в секунду,
Терминация транскрипции происходит после достижения РНК-полимеразой нуклеотидных последовательностей ДНК, являющихся стоп-сигналами. Считают, что такими стоп-сигналами в транскриптоне могут быть поли(А) последовательности, поскольку в транскриптах на З'-конце обнаруживаются комплементарные им поли (У) последовательности. Выделен и специальный фактор терминации — р-фактор, который является белком. Он обрывает транскрипцию, каким-то образом взаимодействуя с терминирующими последовательностями транскриптона. Благодаря терминаторам цепи РНК образуются только определенной длины.
По мере того как транскрипция подходит к концу, синтезированная РНК отделяется от ДНК. Первичные продукты транскрипции, т. е. РНК, являются полными копиями {в комплементарном изображении) транскрипто- нов ДНК- А значит, в новосинтезированной РНК имеются информативные и неинформативные участки, Причем ней и формативные участки, несущие определенные функции в транскриптоне ДНК» очевидно, не нужны в РНК и являются своеобразными издержками транскрипции. Да и перенесены они в РНК потому, что процесс транскрипции непрерывен, а «выборочное» копирование только информативных (структурных) участков транскриптонов вряд ли возможно. Первичные транскрипты нужно освободить от неинформативного груза и оставить только информативную часть молекул РНК, Поэтому первичный транскрнпт называют РНК-предшественником. При транскрипции образуется в основном три типа предшественников РНК:
1) предшественник мРНК, или гетерогенная ядерная РНК {сокращенно Пре-мРНК или ГяРНК), содержащая мРНК, использующуюся в цитоплазме как матрица при синтезе белка;
2) предшественники рРНК (пре-рРНК), содержащие 18S рРНК и 28S рРНК у эукэриотов и, соответственно, 16S и 23S рРНК у прокариотов;
3) предшественник тРНК (пре-тРНК).
Все пре-РНК представляют собой линейные цепи, не замыкающиеся в кольцо. Они длиннее, чем функционирующие молекулы РНК. Особенно неоднородна по молекулярной массе пре-мРНК: от 6—7S до гигантских размеров SO—70S. Это связано с разнообразием молекулярной массы белков, Информация о которых содержится именно в пре-мРНК,
В ядре эукариотов все предшественники связываются с белками, образуя рибонуклеопротеиды-
4. Посттраискрипциоиные изменения РНК
В ядре все предшественники РНК проходят стадию послетранскрипционного созревания, или процессинеа (см. рнс. 67). В ходе процессинга удаляются неинформативные «излишки» в пре-РНК и образуются «зрелые», функциональные молекулы РНК.
Процессинг включает три операции:
1) вырезание неинформативных участков из пре-РНК;
2) сращивание информативных участков «разорванных» генов — сплайсинг;
3) модификация 5'- и З'-концевых участков РНК.
Процессинг пре-мРНК. Вырезание неинформативных участков пре-мРНК осуществляется с помощью рибонуклеаз {экзо- и эндонуклеаз). Они гидро- лизуют фосфодиэфирные связи, начиная с 5'-конца, и оставляют от пре-мРНК необходимую часть готовой мРНК. Если пре-мРНК получена с транскрил- тона, содержащего разорванные гены, то происходит вырезание интронов {участков, не несущих информации), находящихся во внутренней части пре-мРШС Оставшиеся зкзоны сращиваются а единую цепь с помощью специальных РНК-лигаз. В результате восстанавливается, уже после транскрипции, непрерывность генов, кодирующих полипептидные цепи. Далее здесь же в ядре происходит модификация 5'- и 3'-концов образовавшейся мРНК К 5'-концу мРНК присоединяется олигонуклеотид, который называется «колпачком» или «нэпом». Этот «колпачок» состоит, как правило, из днух или трех метилированных нуклеотидов; концевым нуклеотидом является 7-метил- гуанозии, который соединен с остальной мРНК не 5'-*-3', а 5'-»-5' фосфо-. диэфирной связью. Этот метилированный «колпачок» защищает мРНК от. разрушения 5'-экзонуклеазами.
К З'-концу мРНК у эукариот присоединяется полиадениловый фрагмент— • поли {А), состоящий примерно из 200 нуклеотидов. Присоединение осуществляется с помощью поли(А)-полимеразы. Этот поли {А)-фрагмент, очевидно, необходим для транспорта мРНК из ядра в цитоплазму.
Процессинг пре-рРНК- Пре-рРНК образуется в ядрышке, где находятся транскриптоны рРНК В ДНК ядрышка гены 18S и 28S рРНК входят в один транскриптон, где расположены тандемами, т. е. попарно друг за другом. В пре-рРНК их расположение такое же. Размеры пре-рРНК достигают 45S {молекулярная масса порядка 4—5 • 10е). В ходе процессинга остается чуть больше половины пре-рРНК и освобождаются зрелые 18S и 28S рРНК. Часть нуклеотидов рРНК подвергается модификации, которая состоит в метилировании оснований. Реакция осуществляется метилтранс- феразами. В роли донора метильных групп выступает S-аденозилметионин. Зрелые рРНК соединяются в ядре с белками рибосом, поступающих сюда из цитоплазмы, н образуют малую и большую субчастицы рибосом.
Процессинг пре-тРНК. Пре-тРНК образуется в разных местах ДНК хромосом и содержит излишки примерно в 40 нуклеотидов по сравнению со зрелой тРНК. При процессинге рибонуклеаз а ми удаляются излишки нуклеотидов, а затем происходит метилирование оснований тРНК- Этот процесс аналогичен метилированию рРНК. Метилирование препятствует разрушению тРНК нуклеазами. Окончательно зрелая тРНК образуется путем присоединения специфической тройки нуклеотидов (акцепторного конца) — ЦЦА, которое осуществляется специальной РНК-полимеразой.
Транспорт зрелых РНК из ядра в цитоплазму. В отличие от прокариот у чукапиотов имеется ядерная мембрана, черм которую необходимо доставить готовые РНК в цитоплазму, где происходит синтез белка. Все зрелые РНК транспортируются из ядра в цитоплазму в комплексе с белком, который дополнительно защищает их от разрушения и способствует переносу. мРНК связывается с особым белком — информофером, что означает «несущий информацию». Вместе с этим белком РНК доставляется к рибосомам цитоплазмы, где и происходит сборка белка из аминокислот, или трансляция.
5. Молекулярные основы трансляции
При трансляции генетический текст мРНК переводится в линейную последовательность аминокислот полипептидной цепи белка. Поскольку продуктом трансляции является специфический белок, то процесс трансляции в равной степени можно назвать биосинтезом белка.
Процесс трансляции можно разделить на два этапа, которые имеют разную локализацию в клетке: рекогниция, или узнавание амииокислот, и собственно биосинтез белка. Рекогниция протекает в гиалоплазме, а биосинтез белка происходит на рибосомах.
Рекогниция, или узнавание аминокислот
Сущность процесса узнавания аминокислот состоит в том, чтобы соединить аминокислоту со своей тРНК. Структура тРНК обладает качествами потенциального «переводчика», так как в одной молекуле совмещены способности «читать» нуклеотидный текст {антикодон тРНК специфически спаривается с кодоном мРНК) и нести {на акцепторном конце) свою аминокислоту. Однако соединяться со своей аминокислотой тРНК не может. Для этой цели в клеточном соке имеются специальные ферменты, которые по существу выполняют роль «переводчиков», т. е. обеспечивают узнавание тРНК своей аминокислоты,. Эти ферменты называются аминоацил-тРНК-синтетазами {сокращенно АРСазы). Существует как минимум 2D типов АРСаз {по " Числу протеино- генных аминокислот). АРСазы — крупные молекулы {молекулярная масса 100 000—240 000), имеющие четвертичную структуру. Они специфически узнают тРНК и аминокислоту, катализируя их соединение по реакции
О
R—СН—СООН + НО—тРНК + Mg2- • АТФ APOlJ" > R—СН—C~Q—тРНК + АМФ + Н4Р207 NHj NH2
Для этого процесса требуется АТФ {Mg2+ играет роль кофактора), энергия которой используется на образование макроэргической связи в аминоацил- тРНК, т. е. в реакции происходит одновременно активирование аминокислоты •С карбоксильного конца и присоединение её к гидроксилу (З'-ОН) аденозина акцепторного конца (ЦЦА) тРНК. ■ В клетках содержится не 20 тРНК, a примерно 40—60, так как некоторые аминокислоты используют несколько специфичных для них тРНК. Из этого следует, что АРСазы обладают способностью выборочно использовать при узнавании ассортимент тРНК для данной аминокислоты, т. е. ведущим звеном узнавания является аминокислота, а к пей подгоняется своя тРНК (или свои тРНК)
Далее тРНК путем простой диффузии переносит присоединенную к ней аминокислоту к рибосомам, где происходит сборка белка из аминокислот, поступающих в виде разных аминоацил-тРНК-
Биосинтез белка ка рибосомах
Для биосинтеза белка (второго этапа трансляции) требуются: мРНК как генетическая матрица, программа которой определяет порядок чередования аминокислот в белке; амнноацил-тРНК (для чтения «текста» мРНК и как источник аминокислот при сборке белка); рибосомы как молекулярные машины для последовательного соединения аминокислот в полипептидную цепь в соответствии с программой мРНК; ГТФ как источник энергии при синтезе белка в рибосомах; белковые «факторы», помогающие на разных фазах сборки белка в рибосомах, и, наконец, некоторые ионы как кофакторы (Mg2+, К+ и др.).
Что представляют собой рибосомы? Устройство рибосом прокариотов н эукариотов примерно одинаково, Отличаются они лишь молекулярной массой. У эукариотов — 80S рибосомы, у прокариотов они мельче 70S. Состоят рибосомы из двух субчастиц —- большой и малой; «скелет» каждой из них образует рРНК, окруженная белками.
acc^-MOS -» 18S рРНК + белки малой субчастииы
-»-2SS pPHK + 5S рРНК+белки большой субчастицы «(.c-^SOS-kieS рРНК+белки малой субчастииы ua> *60S-*23S рРНК + 55 рРНК+белки большой субчастицы
В состав рибосом входит до 60 белков, функция которых еще во многом не* выяснена. Установлено лишь одно: только в полностью " собранном виде рибосомы активны. Рибосомы, не участвующие в синтезе белка, легко диссоциируют на субчастицы. В клетке рибосомы или находятся в свободном состоянии, т. е. в клеточном соке, или связаны с мембранами эндоплазматической сети. Свободное перемещение рибосом а различные участки клетки или соединение их в разных местах с мембранами эндоплазматического ретикулума, очевидно, дает возможность собирать белки в клетке там, где это нужно.
Механизм синтеза белка на рибосомах
Синтез белка, или собственно трансляцию, принято разделять на три фазы: инициация (начало), элонгация (удлинение полипептндной цепи) и тер- минация (окончание).
Инициация. Начало трансляции — наиболее медленный процесс. В нерабочем состоянии субчастнцы рибосом разомкнуты. мРНК, поступившая из ядра в цитоплазму, связывается с малой субчастицей на поверхности, обращенной к большой субчастнце. Причем точка присоединения к субчастице расположена рядом с 5'-концом РНК, так как «чтение» программы РНК всегда идет в направлении б'-*-3'. В пределах субчастицы умещаются только два кодона мРНК. Первым кодоном мРНК у 5'-конца является АУГ или ГУГ. Эти кадоны называются инициирующими, так как именно с них всегда начинается трансляция в рибосомах. Этим кодонам соответствует антикодон метионил-тРНК. У эукариотов имеются две разные метНОНил-тРНК. Одна нз них всегда участвует в инициации, а другая используется в процессе элонгации. У прокариотов синтез белка начинается с формилметиоиил'тРНК, где NH2-rpynna заблокирована формильной группой,
Кроме того, в инициации участвует как минимум три белковых фактора
инициации (F,, F2, F3), которые не являются составными компонентами рибосом, и ГТФ. Белковые факторы инициации облегчают связывание мРНК с малой субчастицей и ГТФ. К этому первичному комплексу (факторы инициации — малая субчастица — мРНК — ГТФ) присоединяется большая субчастица, т. е. происходит смыкание субчастиц рибосом, после чего факторы инициации удаляются из рибосом. Необходимая для смыкания с^5частнц энергия получается за счет гидролиза ГТФ. Образовавшийся инициаторный комплекс (мРНК, рибосома и метионил-тРНК) готов к элонгации. Причем метионил-тРНК своим антикодоном специфически спаривается с кодоном АУГ мРНК, т. е. как бы «подвешивается» иа водородных связях к мРНК. а акцепторный конец, где находится аминокислота, прикрепляется к большой субчастице рибосом.
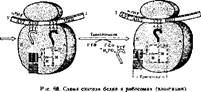
Элонгация. Рассмотрим, как происходит удлинение полипептида на одну аминокислоту (рис. 68), Синтез полипептида всегда начинается от N-конца и заканчивается С-концом. Наращивание полипептида на одну аминокислоту осуществляется в три шага:
1) связывание аминоацил-тРНК;
2) транспептидация (или перенос пептида);
3) транслокацня (или перемещение мРНК на один триплет).

|
|
Первый шаг. 6 рибосомах (как показано на рис. 68) слева находится тРНК, которая антикодоном связана с кодоном мРНК, а акцепторный конец «связан» с растущим пептидом (на рис. 68 изображен дйпептид).
Этот пептид, входящий в пептидил- тРНК, связан с П-участком, который в виде белковой ниши находится на большой субчастице. В момент первого шага второй кодон мРНК свободен. С ним спаривается своим антикодоном поступающая в рибосомы аминоацил-тРНК- Амино- ацильный конец этой тРНК связывается с А-участ'ком большой субчастицы рибосомы. На этом первый шаг, т. е. связывание, заканчивается. На Связывание тратится энергия фосфатной связи ГТФ.
Второй шаг — транспеп- тидация — совершается таким образом, что происходит переброс пептидила с левой тРНК на аминогруппу аминоацил-тРНК- При этом образуется пептидная связь. Катализируют образование пептидной связи белки рибосом, обладающие пептидилтрансферазной активностью.
Третий шаг состоит в размыкании субчастиц рибосом, на что расходуется энергия одной молекулы ГТФ. Пептидил-тРНК, уже несущая трипептид, перемещается из А-участка вместе с мРНК. с которой она спарена, в П-участок на один триплет и выталкивает свободную тРНК нз рибосом. Для синтеза одной пептидной связи (или удлинения полипептида на одну аминокислоту) затрачивается энергия двух молекул ГТФ.
Помогают элонгации так называемые белковые факторы элонгации. Элонгация продолжается до тех пор, пока' весь текст мРНК не будет прочитан.
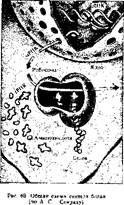
Термннация — окончание трансляции — зависит от присутствия в мРНК терминирующих кодонов, или «стоп-сигналов» (УАА, УГА, УАГ) и белковых факторов терминации. С терминирующими кодонами не может связаться ни одна тРНК, так как нет тРНК с соответствующими антикодонами. Возможно, что белковые факторы терминации освобождают синтезированную полипептидную цепь (рис. 69).
|
В клетке мРНК в синтезе белка использует не одну, а несколько рибосом. Такой работающий комплекс мРНК с несколькими (от 4 до 20) рибосомами называется полирибосомой. Благодаря образованию полирибосом нет нужды в большом числе копий мРНК. В то же время синтез белка протекает быстрее, чем при использовании только одной рибосомы. За секунду полипептидная цепь удлиняется на одну аминокислоту, а в интенсивную фазу роста клеток скорость синтеза нарастает до 20 аминокислот в секунду. После
отделения МРНК от рибосомы она тут же гидролизуется цитоплазматическими рибонуклеазами. Поэтому для биосинтеза тех же белков необходимо вновь • создавать мРНК-
Посттрансляционные изменения
белка
Уже в ходе трансляции белок начинает укладываться в трехмерную структуру, которую он окончательно принимает после отделения синтезированного белка от рибосом. Часть белков синтезируется в виде предшественников. Они подвергаются ограниченному протеолизу в цитоплазме клетки. Очевидно, обработку лротеазами проходит большинство белков, т. е. происходит их своеобразное созревание.
. Значительная часть синтезированных белков остается в клетке. Однако часть белков экспортируется из нее. Особенно •активно выделяются белки железистыми клетками, клетками печени. Как правило! экспортируются из клетки белки, которые синтезируются на рибосомах, связанных с мембранами эндоплазм этического ретикулума. Уже при синтезе растущая полипептидная цепь проникает через мембрану и попадает в каналы эндоплазматической сети. В цистернах эндоплазм этического ретикулума белки концентрируются. Хранение и секреция их происходят в аппарате Гольджи, где к белкам присоединяется углеводный компонент (ставится «углеводный штамп» на пропуск из клетки); они транспортируются наружу путем экзоцитоза. Для этого требуется энергия АТФ, поэтому при дефиците АТФ белки задерживаются в клетке.
Консервация мРНК
Если необходимо сохранить мРНК, а затем вновь использовать ее генетическую программу для сборки нужных белков, требуется защитить ее от действия нуклеаз. В клетках консервация мРНК происходит путем связывания ее со специальными белками цитоплазмы. Такой комплекс белка с мРНК называется информоеомой. При появлении необходимости в мРНК для синтеза белка она связывается с малой субчастицей рибосом и участвует в трансляции. Прием консервации мРНК используется в ходе развития клеток. Функционирующий ген на одной стадии развития нарабатывает продукт — мРНК, которая консервируется в цитоплазме. На следующей стадии развития ген вообще может не функционировать, а информация его тем не менее может использоваться для сборки специфических белков.
6. Биосинтез белка в митохондриях
В митохондриях имеется полная система переноса генетической информации от ДНК к белку. ДНК митохондрий сходна по размерам и кольцевой форме с бактериальной. Однако размеры ДНК и возможное количество генов в ней не позволяют кодировать синтез всех белков, находящихся в митохондриях. Очевидно, часть белков митохондрий синтезируется на собственных рибосомах, а часть на рибосомах цитоплазмы и затем встраивается внутрь митохондрий. Какие конкретно белки синтезируются в митохондриях и какие в цитоплазме, еще остается неясным.
7. Генетический код, его свойства
Под генетическим, или аминокислотным, кодом понимают соответствие кодо- ноа (кодовых слов) определенным аминокислотам. Генетический код — своеобразный словарь, переводящий текст, записанный с помощью четырех нуклеотидов, в белковый текст, записанный с помощью 20 аминокислот. Остальные аминокислоты, встречающиеся в белке, являются модификациями одной из 20 аминокислот.
Первое кодовое слово было расшифровано Ниренбергом н Маттеи в 1961 г. Они получили из кишечной палочки экстракт, содержащий рибосомы и прочие факторы, необходимые для синтеза белка. Получилась бесклеточная система для синтеза белка, которая могла бы осуществлять сборку белка из аминокислот, если в среду добавить необходимую мРНК. Добавив в среду синтетическую РНК, состоящую только из урацилов, они обнаружили, что образовался белок, состоящий только нз фенилаланина (полнфенилала> нин). Так было установлено, что кодон УУУ соответствует фенилаланину, В течение последующих 6—6 лет были определены все кодоны генетического кода.
Генетический код имеет следующие свойства.
1. Тригштность — каждой аминокислоте соответствует тройка нуклеотидов. Легко подсчитать, что существуют 4Э => 64 кодона. Из них 61 является смысловым и 3 — бессмысленными (терминирующими).
2. Неперекрываемость — каждый из триплетов генетического текста независим друг от друга. Ниже показана разница между перекрывающимся н неперекрывающимся кодом:
| —ДЦАУУУЦГА, — • I > 2 3 Неперекрывающийся |
—1ШАУУУЦГА— 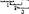 перекрывающийся перекрывающийся
|
В последнее время появились сообщения, что код иногда бывает перекрывающимся.
• 3. Вырожденность, или избыточность, — отдельные аминокислоты имеют несколько кодонов. Об этом говорит простое сравнение: на 20 аминокислот приходится 61 смысловой кодон, т. е. в среднем каждой аминокислоте соответствует около 3 кодонов. Причина вырожденности кода состоит в том, что главную смысловую нагрузку несут два первых нуклеотида в триплете, а третий не так важен. Отсюда правило вырожденности кода: если два кодона имеют два одинаковых первых нуклеотида, а их третьи нуклеотиды принадлежат к одному классу (пуриновому или пиримидиновому), то они кодируют одну и ту же аминокислоту.
Однако из этого идеального правила есть два исключения. Эю кодон АУА, который должен соответствовать не изолейцину, а метионину и кодон УГА, который является терминирующим, тогда как должен соответствовать триптофану, Вырожденность кода имеет, очевидно, приспособительное значение,
4. Специфичность — каждой аминокислоте соответствуют только определенные кодоны, которые не могут использоваться для другой аминокислоты.
5. Колинеарность — соответствие линейной последовательности кодонов мРНК и аминокислот в белке.
6. Универсальность — все перечисленные выше свойства генетического кода характерны для всех живых организмов. В последнее время принцип универсальности кода поколеблен ш связи с тем, что в митохондриях собственный генетический код отличается от известного ранее. В нем кодой УГА соответствует триптофану, а АУА — метионииу, как того требует правило вырожденности кода. Возможно, в начале эволюции у всех простейших организмов был такой же код, как и у митохондрий, а затем он претерпел небольшие отклонения.