
Главная страница Случайная страница
КАТЕГОРИИ:
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Дифениламина (ДФА).
|
|
На предметное стекло поместите несколько кристаллов ДФА, а на них 2-3 капли H2SO4 конц.
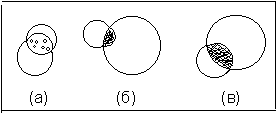 Стеклянной палочкой размешайте кристаллы до их растворения, т.е. образования соли гидросульфата дифениламмония. С помощью стеклянной палочки перенесите часть раствора образовавшейся соли на другие участки предметного стекла (см. рис.7.)для проведения нескольких ка-
Стеклянной палочкой размешайте кристаллы до их растворения, т.е. образования соли гидросульфата дифениламмония. С помощью стеклянной палочки перенесите часть раствора образовавшейся соли на другие участки предметного стекла (см. рис.7.)для проведения нескольких ка-
пельных проб.на предметном стекле:
Рис. 7. Капельные реакции ДФА
(а) гидролиз соли (оп.9.1.);
(б) реакция с HNO3 (оп.9.2.);
(в) реакция с NaNO3 (оп.9.2).
Добавьте на край одной из капель (другой палочкой) каплю воды. В месте соприкосновения раствора соли и воды немедленно происходит гидролиз соли и выделение белого осадка свободного ДФА. Напишите реакции образования и гидролиза гидросульфата дифениламмония.
(Амины - органические основания. Анилин – (фениламин) –более слабое основание, чем алифатические амины: неподеленная пара электронов азота взаимодействует с сопряженной электронной системой бензольного ядра. Введение второй фенильной группы еще больше ослабляет основные свойства аммиака, ДФА образует соли только с концентрированными кислотами, а при разбавлении водой немедленно происходит гидролиз соли).
Опыт 9.2. Цветная реакция ДФА с HNO3 и нитратами.
Приготовить очень разбавленный раствор азотной кислоты: в пробирку 1 кап. HNO3 и долить водой почти до верха.
Одну каплю полученного разбавленного раствораHNO3 поместить на предметное стекло рядом с каплей сернокислого раствора ДФА. В месте соприкосновения капель (см. рис.7б) появляется интенсивное синее окрашивание.
Чтобы избежать гидролиза, - при проведении цветной реакции нужно
о с т е р е г а т ь с я и з б ы т к а в о д ы.
Дифениламин является реактивом на HNO3, т.к. при действии ее на раствор ДФА в конц. H2SO4 образуется темно-синего цвета аммониевая соль дифенилбензидина:

Интенсивная окраска вещества обусловлена наличием в молекуле системы сопряженных двойных связей.
Реакция используется для количественного колориметрического количественного определения концентрации HNO3.
Сделайте аналогичные пробы с растворами NaNO3, NaNO2, KMnO4.Эта реакция очень чувствительна и широко используется для санитарно-химического контроля загрязнения овощей нитратами, а рек – сточными водами.
Опыт 9.3. Щелочной гидролиз ацетамида.
Поместить в пробирку несколько кристаллов ацетамида, добавить 8 капель NaNO2 и 2 кап. конц. HNO3. Греть на спиртовке. Влажным красным лакмусом обнаружить аммиак.
Написать уравнение реакции.
Опыт 9.4. Дезаминирование ацетамида.
Поместить в пробирку несколько кристаллов ацетамида, добавит 2-3 капли NaNO2 и 2 капли конц. HNO3. Греть на спиртовке. С помощью влажного красного лакмуса убедиться в отсутствии аммиака в отходящем газе. Зафиксировать появление запаха уксусной кислоты.
Написать уравнение реакции.
Опыт 9.5. Растворимость мочевины в воде и образование ее
азотнокислой соли.
(а) В пробирку насыпать 1 лопаточку сухой мочевины, добавить 1 каплю Н2О (отметить очень хорошую растворимость мочевины в воде).
(б) к раствору мочевины добавить 2 капли конц. HNO3 и встряхнуть, - сразу или через несколько секунд начинается образование кристаллов азотнокислой мочевины (реагирует мочевина с одной молекулой HNO3).
Написать уравнение реакции.
Кристаллы сохранить для следующего опыта.
Опыт 9.6. Дезаминирование мочевины.
К кристаллам азотнокислой соли мочевины (из оп. 9.5.) добавить 2-3 капли NаNO2 (написать уравнение реакции образования NaNO2). При встряхивании немедленно начинается выделение газа (СО2 и N2). С помощью влажного красного лакмуса убедиться, что здесь нет аммиака.
Написать уравнение.
Реакция разложения мочевины азотистой кислотой испльзуется для количественного определения мочевины по методу ван Слайка (измеряется объем выделившегося азота).
Опыт 9.7. Гидролиз мочевины, доказательство ее строения.
 В пробирку поместить 1 лопаточку мочевины и добавить (не смачивая стенок пробирки) 6 капель Ba(OH)2. Пробку закрыть не плотно и вставить влажный красный лакмус (рис.8). Греть 15-20 мин. на водяной бане. Объяснить посинение лакмуса и появление мути в пробирке.
В пробирку поместить 1 лопаточку мочевины и добавить (не смачивая стенок пробирки) 6 капель Ba(OH)2. Пробку закрыть не плотно и вставить влажный красный лакмус (рис.8). Греть 15-20 мин. на водяной бане. Объяснить посинение лакмуса и появление мути в пробирке.
Написать уравнение реакции.
Рис.8
Опыт 9.8. Разложение мочевины при нагревании. Образование